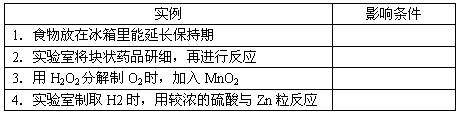
题目内容
把镁条投入盛有盐酸的烧杯中,产生H2的速率可由下图表示。
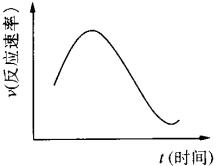
在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是

在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
| A.①④ | B.③④ | C.①②③ | D.②③ |
C
镁条和盐酸反应产生H2的反应方程式为: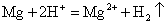 ,是镁与酸中的H+间的置换反应,与Cl-无关,故④不是影响该反应速率的因素 ;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸接触面积不断增大,则产生H2的速率会加快。溶液的温度对该反应也有影响,温度越高,产生H2的速率越快。随着反应的进行,H+浓度不断减少,则反应速率会逐渐减慢,故选C。
,是镁与酸中的H+间的置换反应,与Cl-无关,故④不是影响该反应速率的因素 ;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸接触面积不断增大,则产生H2的速率会加快。溶液的温度对该反应也有影响,温度越高,产生H2的速率越快。随着反应的进行,H+浓度不断减少,则反应速率会逐渐减慢,故选C。
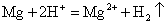 ,是镁与酸中的H+间的置换反应,与Cl-无关,故④不是影响该反应速率的因素 ;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸接触面积不断增大,则产生H2的速率会加快。溶液的温度对该反应也有影响,温度越高,产生H2的速率越快。随着反应的进行,H+浓度不断减少,则反应速率会逐渐减慢,故选C。
,是镁与酸中的H+间的置换反应,与Cl-无关,故④不是影响该反应速率的因素 ;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸接触面积不断增大,则产生H2的速率会加快。溶液的温度对该反应也有影响,温度越高,产生H2的速率越快。随着反应的进行,H+浓度不断减少,则反应速率会逐渐减慢,故选C。
练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
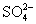 的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明
的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明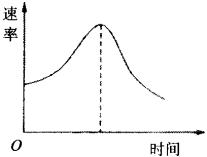
 2NH3。已知加入1 mol N2和4 mol H2时,达到平衡后生成a mol NH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
2NH3。已知加入1 mol N2和4 mol H2时,达到平衡后生成a mol NH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空: