题目内容
18.下列指定反应的离子方程式正确的是( )| A. | Fe和足量稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| B. | 将Fe(NO3)3溶液与少量HI混合:8H++2NO3-+6I-═4H2O+3I2+2NO↑ | |
| C. | 用过量氨水吸收SO2的反应:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 少量Ca(OH)2和NaHCO3反应 Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.发生碘离子与硝酸根离子的氧化还原反应;
C.反应生成亚硫酸铵;
D.反应生成碳酸钙、碳酸钠和水.
解答 解:A.Fe和足量稀硝酸反应的离子反应为Fe+NO3-+4H+═Fe3++NO↑+2H2O,故A错误;
B.将Fe(NO3)3溶液与少量HI混合的离子反应为8H++2NO3-+6I-═4H2O+3I2+2NO↑,故B正确;
C.用过量氨水吸收SO2的反应的离子反应为2NH3•H2O+SO2═2NH4++SO32-+H2O,故C错误;
D.少量Ca(OH)2和NaHCO3反应的离子反应为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
9.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1mol Na2O2固体中含离子总数为3NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
6.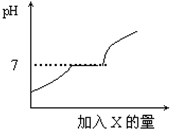 常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
 常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
3.CH3CH=CHCOOH,该有机物能发生的反应是( )
①取代反应 ②加成反应 ③使溴水褪色④使酸性KMnO4溶液褪色 ⑤酯化反应 ⑥聚合反应.
①取代反应 ②加成反应 ③使溴水褪色④使酸性KMnO4溶液褪色 ⑤酯化反应 ⑥聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑤不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
10.有A、B两种原子,B原子的M层比A原子的M层多3个电子,B原子L层电子数恰为A原子L层电子数的2倍.A和B分别是( )
| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
7.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A. | ZW3为非极性分子 | B. | 原子半径:Z>X>Y | ||
| C. | W的单质是制取盐酸的原料之一 | D. | XW3中W显+1价 |
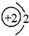 、O
、O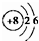 、Ca
、Ca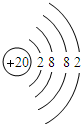 .
.
