题目内容
【题目】2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
A. PCl5的物质的量大于0.20 molB. PCl5的质量分数减少
C. 平衡常数不变D. 混合气体的黄绿色变浅
【答案】A
【解析】
A、充入2.0molPCl3和1.0molCl2反应达到平衡,产生PCl5为0.4mol,相同条件下,充入1.0molPCl3和0.50molCl2,应产生PCl3物质的量为0.20mol,但移走1.0molPCl3和0.50molCl2,相当于在原来的基础上减少1.0molPCl3和0.50molCl2,减小压强,平衡向逆反应方向移动,PCl5被消耗,其物质的量将小于0.20mol,故A说法错误;B、根据A选项分析,PCl3被消耗,其质量分数减小,故B说法正确;C、化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,故C说法正确;D、减小压强,相当增大体积,氯气的浓度降低,黄绿色变浅,故D说法正确。

【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
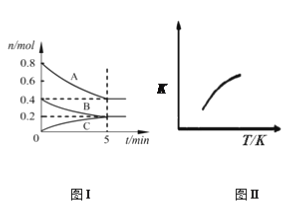
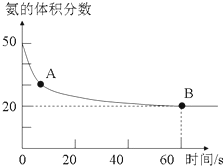
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现 将体积比为2∶1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)![]() NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
①上述反应的焓变:ΔH__0,熵变ΔS__0(填“>”“<”或“=”)。
②下列说法能说明上述反应建立化学平衡状态的是_______。
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化 D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=_____(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的______倍。