题目内容
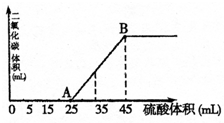 向100mL NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol?L-1的硫酸,所加入硫酸溶液的体积与产生CO2的体积关系如图所示:
向100mL NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol?L-1的硫酸,所加入硫酸溶液的体积与产生CO2的体积关系如图所示:(1)当加入45mL硫酸溶液时,产生二氧化碳的物质的量为
0.04
0.04
mol;(2)计算原氢氧化钠浴液的物质的量浓度
0.9mol/L
0.9mol/L
. (不要求写计算过程)分析:25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,碳酸氢钠完全反应消耗硫酸20mL,小于25mL,说明加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,
(1)根据n=cV计算硫酸的物质的量,再根据方程式计算生成二氧化碳的物质的量;
(2)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,根据硫酸根守恒计算n(Na2SO4),再根据钠离子守恒计算n(NaOH),根据c=
计算原氢氧化钠浴液的物质的量浓度.
(1)根据n=cV计算硫酸的物质的量,再根据方程式计算生成二氧化碳的物质的量;
(2)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,根据硫酸根守恒计算n(Na2SO4),再根据钠离子守恒计算n(NaOH),根据c=
| n |
| V |
解答:解:25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,碳酸氢钠完全反应消耗硫酸20mL,小于25mL,说明加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,
(1)碳酸氢钠完全反应消耗硫酸为45mL-25mL=20mL,则硫酸的物质的量为0.02L×1mol/L=0.02mol,故n(H+)=0.04mol,由HCO3-+H+═H2O+CO2↑可知,生成二氧化碳为0.04mol,
故答案为:0.04;
(2)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,消耗硫酸的物质的量为0.045L×1mol/L=0.045mol,根据硫酸根守恒可知n(Na2SO4)=n(H2SO4)=0.045mol,根据钠离子守恒可知n(NaOH)=2n(Na2SO4)=2×0.045mol=0.09mol,原氢氧化钠浴液的物质的量浓度为
=0.9mol/L,
故答案为:0.9mol/L.
(1)碳酸氢钠完全反应消耗硫酸为45mL-25mL=20mL,则硫酸的物质的量为0.02L×1mol/L=0.02mol,故n(H+)=0.04mol,由HCO3-+H+═H2O+CO2↑可知,生成二氧化碳为0.04mol,
故答案为:0.04;
(2)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,消耗硫酸的物质的量为0.045L×1mol/L=0.045mol,根据硫酸根守恒可知n(Na2SO4)=n(H2SO4)=0.045mol,根据钠离子守恒可知n(NaOH)=2n(Na2SO4)=2×0.045mol=0.09mol,原氢氧化钠浴液的物质的量浓度为
| 0.09mol |
| 0.1L |
故答案为:0.9mol/L.
点评:本题考查混合物的有关计算,难度中等,清楚各阶段发生的反应是关键,利用守恒思想进行计算,侧重对学生思维能力、分析问题能力的考查.

练习册系列答案
相关题目
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4