题目内容
15.下列说法不正确的是( )| A. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(CH3COOH)}{c(CH3COO-)}$ 的值减小 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{{{{(cα)}^2}}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
分析 A.加速稀释促进CH3COOH电离,导致溶液中n(CH3COOH)减小,n(CH3COO-)增大;
B.电离平衡常数只有温度有关,温度不变,电离平衡常数不变;
C.环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3;
D.根据盖斯定律计算4Fe(s)+3O2(g)═2Fe2O3(s)的焓变.
解答 解:A.加速稀释促进CH3COOH电离,导致溶液中n(CH3COOH)减小,n(CH3COO-)增大,所以稀释过程中存在$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小,故A正确;
B.电离平衡常数只有温度有关,温度不变,电离平衡常数不变,所以一定温度下,向醋酸中加入醋酸钠,抑制醋酸电离,但醋酸电离平衡常数不变,故B错误;
C.环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊的稳定结构,故C正确;
D.①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol.
③C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
将方程式[(③-②)×3-①]×2得4Fe(s)+3O2(g)═2Fe2O3(s),则△H=[(-393.5+283.0)×3-489.0]kJ/mol×2=-1641.0 kJ/mol,故D正确;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、盖斯定律、物质结构等知识点,明确弱电解质电离特点、盖斯定律内涵等即可解答,注意:电离平衡常数只与温度有关,与溶液酸碱性及浓度无关,为易错点.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(2)写出C元素的单质的电子式
 .
.(3)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
(4)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物 的水化物中化学性质明显不同于其他三种的是H2CO3(写化学式).
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 | |
| B. | 鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 苯不能使酸性高锰酸钾溶液褪色,而甲苯则能,因甲苯被氧化为苯甲酸 | |
| E. | 工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应 |
| A. | 向AgNO3溶液中通入少量HCl | B. | 向H2SO3溶液中通入Cl2 | ||
| C. | 向FeI2溶液中通入少量Cl2 | D. | 向NaOH溶液中通入少量Cl2 |
| A. | 1.4 g | B. | 2.8 g | ||
| C. | 4.4 g | D. | 在1.4 g和2.8 g之间 |
 苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
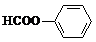 +2NaOH-→HCOONa+
+2NaOH-→HCOONa+ +H2O.
+H2O.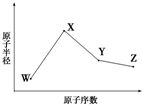 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.