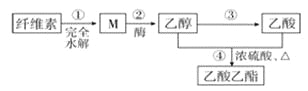
题目内容
【题目】下列说法正确的是( )
A. 沸点大小:HI>HBr>HCl>HF
B. HF很稳定性很强,是因为分子间能形成氢键
C. 冰、水和水蒸气中都含有氢键
D. 构成单质分子的微粒之间不一定存在共价键
【答案】D
【解析】A. HF分子间存在氢键,则沸点大小:HF>HI>HBr>HCl,A错误;B. HF很稳定性很强,是因为F是最活泼的非金属,氢键不能影响物质的稳定性,B错误;C. 水蒸气中不存在氢键,C错误;D. 构成单质分子的微粒之间不一定存在共价键,例如稀有气体,D正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目