题目内容
【题目】Ⅰ、某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
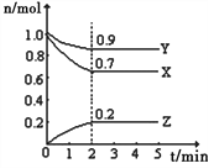
(1)该反应的化学方程式为_______________________。
(2)反应开始至2min,以气体X表示的平均反应速率为_________。反应达限度时,Y的转化率为________,反应开始时与反应达平衡状态时的压强之比为__________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9 mol/(L·min),乙中v(Y)=0.1 mol/(L·s),则__________中反应更快。
Ⅱ、某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。

(4)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是___________。
(5)从能量转化的角度来看, A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(6)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置电子流向:负极→外线路→正极→电解质→负极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
【答案】 3X+Y![]() 2Z 0.075mol/(L·min) 10% 10:9 乙 负 Zn - 2e- = Zn2+ 有大量无色气泡产生 热能 电能 AD
2Z 0.075mol/(L·min) 10% 10:9 乙 负 Zn - 2e- = Zn2+ 有大量无色气泡产生 热能 电能 AD
【解析】试题分析:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2。(2)根据![]() 计算用x表示反应的平均速率;Y的转化率=变化量÷初始量,压强之比等于物质的量比。
计算用x表示反应的平均速率;Y的转化率=变化量÷初始量,压强之比等于物质的量比。
(3)反应速率之比是相应的化学计量数之比判断;
(4)B构成原电池,锌的活泼性大于铜; Zn是负极,负极反应是Zn - 2e- = Zn2+,Cu是正极,正极反应是![]() 。
。
(5)从能量转化的角度来看, A锌与硫酸反应放热,B是原电池将化学能转变为电能。
(6)根据原电池原理分析。
解析:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y![]() 2Z。
2Z。
(2)根据![]() ,用x表示反应的平均速率=
,用x表示反应的平均速率=![]() 0.075mol/(L·min);
0.075mol/(L·min);
Y的转化率=变化量÷初始量=![]() ,压强之比等于物质的量比,反应开始时与反应达平衡状态时的压强之比为
,压强之比等于物质的量比,反应开始时与反应达平衡状态时的压强之比为![]() 。
。
(3) 甲中![]() 3 mol/(L·min) ,乙中
3 mol/(L·min) ,乙中![]() 0.1 mol/(L·s)=6 mol/(L·min) ,所以乙中反应更快;
0.1 mol/(L·s)=6 mol/(L·min) ,所以乙中反应更快;
(4)B构成原电池,锌的活泼性大于铜; Zn是负极,负极反应是Zn - 2e- = Zn2+,Cu是正极,正极反应是![]() ,所以正极有大量无色气泡产生。
,所以正极有大量无色气泡产生。
(5)A锌与硫酸反应放热,A中是将化学能转变为热能,B是原电池将化学能转变为电能。
(6)A.原电池有 电流通过,所以原电池反应的过程中一定有电子转移 ,故A正确;
B.原电池装置电子流向:负极→外线路→正极,故B错误;
C.铜锌原电池中锌参加反应,故C错误;
D.负极发生氧化反应,正极发生还原反应,故D正确。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】镁及其化合物在现代工业中有着广泛的用途。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为_______, 1mol“17MgH2+12Al”与足量Na0H溶液反应时生成的气体的质量是___________g。
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是_________,若镁过量,则产物为两种镁的二元化合物,写出反应的化学方程式:______。
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。

开始沉淀时的PH | 完全沉淀时的pH | |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.7 | 11 |
① Mg9FeSi5O20中铁元素的化合价为____,pH的调节范围是______.
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为__________。
③ 写出料渣Ⅱ的一种用途:______。一般认为c(Mg2+)≤1×10-5mol/L时,Mg2+已完全沉淀,则Mg(OH)2的Ksp=______。写出生成碱式碳酸镁的离子方程式:____________。