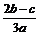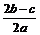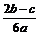题目内容
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.NA个N2分子与0.5 NA个H2分子所占的体积比一定是2 : 1 |
| B.相同物质的量的OH-和CH3+含有相同数目的电子 |
| C.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D.常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA |
D
解析试题分析:A、没有指明是否为相同的温度和压强,所以N2与H2的体积比无法确定,错误;B、OH?的电子数为10,CH3+含的电子数为8,所以相同物质的量的OH-和CH3+含有的电子数不同,错误;C、没有指明溶液的体积,所以pH=13的Ba(OH)2溶液中含有OH-的数目无法确定,错误:D、由化学方程式:3NO2+H2O =2HNO3+NO,根据化合价的变化可得:NO ~ 2e?,所以生成0.1molNO,转移的电子数为0.2NA,正确。
考点:本题考查阿伏伽德罗常数的应用。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值。下列叙述不正确的是
| A.7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B.15g甲醛(HCHO)和乙酸的混合物中氧原子数为0. 5NA |
| C.一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D.常温下,2L pH=12的Na2CO3溶液中含有OH—数目为0.02NA |
下列叙述正确的是 ( )
A.1 mol N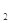 参加氧化还原反应时电子转移数为3×6.02×10 参加氧化还原反应时电子转移数为3×6.02×10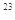 |
B.常温常压下,22.4L SO2含分子的个数为6.02×10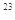 |
C.物质的量浓度为0.5 mol·L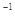 的MgCl 的MgCl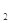 溶液,含有的Cl 溶液,含有的Cl 数为6.02×10 数为6.02×10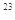 |
D.16g O2所含氧原子个数为6.02×10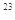 |
下列有关说法正确的是( )
| A.标准状况下的SO2和SO3的密度比为4:5 |
| B.1 g甲烷和1 g氧气的原子数之比为5∶1 |
| C.同温同压下,等物质的量的N2O4和NO2两种气体体积比为1:2 |
| D.同温同压下,等质量的O2和SO2的所含原子个数比为1∶1 |
常温下,向20 L的真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5)。反应完全后,容器内气体可能达到的最大密度是( )
| A.24.5 g/L | B.14.4 g/L | C.8 g/L | D.5.19 g/L |
常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA为阿伏加德罗常数的值)( )
| A.反应物的总体积为0.448 L |
| B.装置中氢元素的总质量为0.04 g |
| C.生成物中含有0.01NA个分子 |
| D.生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
| D.0.5 mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S—S键 |

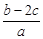
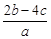
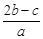
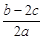
 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为( )
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为( )