题目内容
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 ( )
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲,乙,丙的氧化物均为共价化和物 |
| D.乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
AD
试题分析:短周期元素甲乙丙丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,则甲为H,乙位于第VA族,乙为N;甲和丙同主族,丙为Na;丁的最外层电子数和电子层数相等,则丁在第三周期第ⅢA族,即丁为Al,A、同周期原子半径从左向右减小,电子层越多,半径越大,则原子半径为丙>丁>乙,故A正确;B、金属性越强,单质的还原性越强,则单质的还原性丙>丁>甲,故B错误;C、甲、乙的氧化物为共价化合物,丙的氧化物为离子化合物,故C错误;D、乙、丙、丁的最高价氧化物对应的水化物分别为硝酸、氢氧化钠、氢氧化铝,氢氧化铝为两性氢氧化物,能相互反应,故D正确;故选D。

练习册系列答案
相关题目
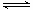 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac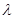 与光的频率v的关系为
与光的频率v的关系为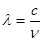 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: