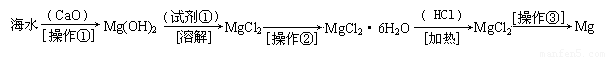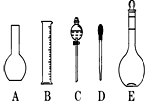题目内容
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
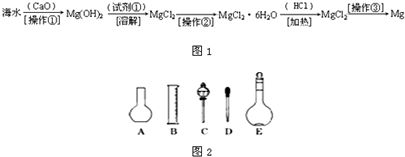
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。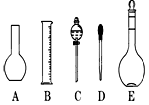
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; | B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; | D.称量碳酸钠晶体时所用砝码生锈; |
(一)(4分)(1) NaOH溶液 (2)饱和NaCl溶液 (3)Cl2(4)CO2 (每格1分)
(二)(6分)CaO+H2O+MgCl2=Mg(OH)2+CaCl2(2分)过滤(1分) HCl(1分)蒸发浓缩,冷却结晶,过滤(2分)
(三)(8分)(1)14.3;(2)AC 500 (3)①③⑤
(4)dbac (5)2 (6)CE (第(6)题2分,其它每格1分,共8分)
解析试题分析:(一),除去MgO中的Al2O3,利用Al2O3的两性,可加氢氧化钠溶液除去。
除去Cl2中的HCl,可用饱和NaCl溶液,HCl溶于饱和NaCl溶液,而Cl2在饱和NaCl溶液中溶解有限。除去FeCl3中的FeCl2,通入Cl2,使Fe2+转为Fe3+。除去NaHCO3溶液中的Na2CO3,通入CO2,使Na2CO3转化为NaHCO3。
(二)海水中加入氧化钙生成氢氧化镁的化学方程式为CaO+H2O+MgCl2=Mg(OH)2+CaCl2
操作①是过滤出Mg(OH)2,之后加入试剂①HCl,溶解后蒸发浓缩,冷却结晶,过滤,经操作③最终可得金属镁。
(三)实验室配制480ml 0.1 mol·L-1的Na2CO3溶液应称取十水碳酸钠晶体为
(2)配制溶液不需要用到的仪器是A和C,所需玻璃仪器E为容量瓶,其规格为500mL。
(3)容量瓶上标有温度、容量、刻度线。
4)配制所需的主要仪器,先后的操作顺序是先用托盘天平称量,称量后放在烧杯中,溶解后转移到容量瓶中,胶头滴管定容。
(5)玻璃棒在配制溶液的过程中玻璃棒共起到了搅拌作用和引流两种用途。
(6)使溶液的浓度偏低的情况有C.碳酸钠晶体不纯,其中混有氯化钠;和E.定容时仰视刻度线,C项中碳酸钠晶体含有氯化钠使所配的溶液深度偏低。E项中仰视读数使所得的读数偏低,从而使所得的溶液浓度偏低。A项无影响,B项使浓度偏大,D项也是使浓度偏大。
考点:溶液的配制
点评:考查溶液配制的操作要领及注意的事项,难度不大,考生在平时要注意观察实验的规范操作,熟记操作要领。