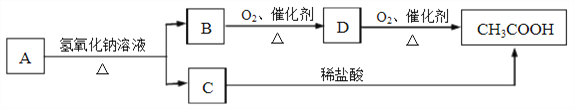
��Ŀ����
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol��L��1��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������жϴ������( )
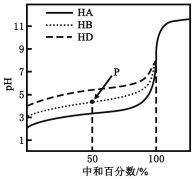
A��������ĵ��볣����ϵ��KHA>KHB>KHD
B���ζ���P��ʱ����Һ�У�c(B��)>c(Na��)>c(HB)>c(H��)>c(OH��)
C��pH=7ʱ��������Һ�У�c(A��)=c(B��)=c(D��)
D�����кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)
���𰸡�C
��������A������ͼ��0.1mol��L��1��������(HA��HB��HD)��Һ��HA����ʼpH��С��������ǿ��HD��pH�����������������Խǿ������ƽ�ⳣ��Խ��������ĵ��볣����ϵ��KHA>KHB>KHD����ȷ��B���ζ���P��ʱ����Ϊ�����ʵ���Ũ�ȵ�HB��NaB����Һ�����ԣ�HB�ĵ���Ϊ����������̶Ƚ�С�����c(B��)>c(Na��)>c(HB)>c(H��)>c(OH��) ����ȷ��C��pH=7ʱ��������Һ�������ӵ�ˮ��̶Ȳ�ͬ��������������Ƶ������ͬ����������Ũ�ȷֱ���������Ũ����ȣ���������Һ��������Ũ�Ȳ��ȣ�����D����Ϊ�����Һ�������غ��ϵʽ��c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)����ȷ����ѡC��