题目内容
(2008?闵行区模拟)如图是198K时N2与H2反应过程中使用催化剂和不使用催化剂条件下能量变化的曲线图.下列叙述正确的是( )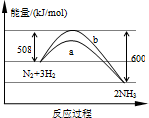

分析:A、根据图示反应物和生成物总能量大小确定是吸热还是放热;
B、根据催化剂与能耗的关系分析;
C、根据盖斯定律分析;
D、根据△H=断裂旧化学键吸收的能量-形成新化学键放出的能量和合成氨为可逆反应考虑.
B、根据催化剂与能耗的关系分析;
C、根据盖斯定律分析;
D、根据△H=断裂旧化学键吸收的能量-形成新化学键放出的能量和合成氨为可逆反应考虑.
解答:解:A、从图示看,该反应反应物的能量高于生成物的能量,所以该反应为放热反应,故A错误;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故B正确;
C、根据盖斯定律,反应热与反应的起始态有关,与反应途径无关,故C错误;
D、根据△H=断裂旧化学键吸收的能量-形成新化学键放出的能量=508kJ/mol-600kJ/mol=-92kJ/mol,
该能量表示有lmol氮气和3mol氢气完全反应生成2mol氨气放出的能量.由于该反应为可逆反应,一定条件下在密闭容器中含有1mol氮气与3mol氢气,充分反应后生成的氨气小于2mol,故放出的能量小于92kJ/mol,故D错误.
故选B.
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故B正确;
C、根据盖斯定律,反应热与反应的起始态有关,与反应途径无关,故C错误;
D、根据△H=断裂旧化学键吸收的能量-形成新化学键放出的能量=508kJ/mol-600kJ/mol=-92kJ/mol,
该能量表示有lmol氮气和3mol氢气完全反应生成2mol氨气放出的能量.由于该反应为可逆反应,一定条件下在密闭容器中含有1mol氮气与3mol氢气,充分反应后生成的氨气小于2mol,故放出的能量小于92kJ/mol,故D错误.
故选B.
点评:本题考查了化学反应中能量转化的原因等知识点,难度不大,题易错选D,特别要注意可逆反应的特点.

练习册系列答案
相关题目




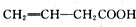

 ;
;