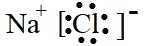题目内容
A元素原子M电子层上有6个电子.B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子.
(1)B元素的原子结构示意图为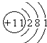
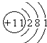 .
.
(2)A、B两元素形成的常见化合物的电子式是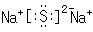
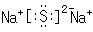 ,该化合物在无色火焰上灼烧时,火焰呈
,该化合物在无色火焰上灼烧时,火焰呈
(3)在上述化合物水溶液中通入氯气发生反应的离子方程式是:
(1)B元素的原子结构示意图为
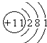
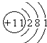
(2)A、B两元素形成的常见化合物的电子式是
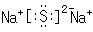
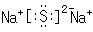
黄
黄
色.(3)在上述化合物水溶液中通入氯气发生反应的离子方程式是:
Cl2+S2-=S↓+2Cl-
Cl2+S2-=S↓+2Cl-
.分析:A元素原子M电子层上有6个电子,核外各层电子分别为2、8、6,原子序数为16,应为S元素,B元素与A元素的原子核外电子层数相同,则原子核外有3个电子层,B元素的原子最外电子层只有1个电子,则核外各层电子数分别为2、8、1,原子序数为11,应为Na元素,结合对应单质及化合物的性质解答该题.
解答:解:A元素原子M电子层上有6个电子,核外各层电子分别为2、8、6,原子序数为16,应为S元素,B元素与A元素的原子核外电子层数相同,则原子核外有3个电子层,B元素的原子最外电子层只有1个电子,则核外各层电子数分别为2、8、1,原子序数为11,应为Na元素,
(1)B为Na元素,原子序数为11,核外有3个电子层,各层电子分别为2、8、1,原子结构示意图为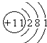 ,故答案为:
,故答案为: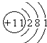 ;
;
(2)A、B两元素形成的常见化合物Na2S,为离子化合物,电子式为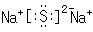 ,Na元素的焰色反应呈黄色,
,Na元素的焰色反应呈黄色,
故答案为: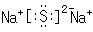 ;黄;
;黄;
(3)氯气具有强氧化性,Na2S具有还原性,在水溶液中氧化还原反应生成单质S,反应的离子方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-.
(1)B为Na元素,原子序数为11,核外有3个电子层,各层电子分别为2、8、1,原子结构示意图为
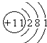 ,故答案为:
,故答案为: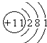 ;
;(2)A、B两元素形成的常见化合物Na2S,为离子化合物,电子式为
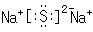 ,Na元素的焰色反应呈黄色,
,Na元素的焰色反应呈黄色,故答案为:
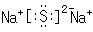 ;黄;
;黄;(3)氯气具有强氧化性,Na2S具有还原性,在水溶液中氧化还原反应生成单质S,反应的离子方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-.
点评:本题考查原子结构与元素的性质,题目难度不大,注意结构示意图、电子式的书写.

练习册系列答案
相关题目