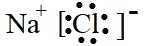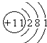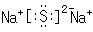题目内容
A元素原子M电子层上有6个电子.B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子.
(1)B元素的原子结构示意图为
 .
.
(2)A、B两元素形成的化合物的名称是
(1)B元素的原子结构示意图为


(2)A、B两元素形成的化合物的名称是
硫化钠
硫化钠
,化学式是Na2S
Na2S
,该化合物在无色火焰上灼烧时,火焰呈黄
黄
色.分析:A元素原子M电子层上有6个电子,核外电子排布为2、8、6,则原子序数为16,应为S元素,B元素与A元素的原子核外电子层数相同,应为第三周期元素,B元素的原子最外电子层只有1个电子,应为第ⅠA族元素,则B为Na元素,以此进行分析.
解答:解:A元素原子M电子层上有6个电子,核外电子排布为2、8、6,则原子序数为16,应为S元素,B元素与A元素的原子核外电子层数相同,应为第三周期元素,B元素的原子最外电子层只有1个电子,应为第ⅠA族元素,则B为Na元素,
(1)B为Na元素,原子核外有3个电子层,最外层电子数为1,则原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)A为S元素,B为Na元素,二者形成的化合物为Na2S,,名称为硫化钠,Na元素的焰色反应为黄色,
故答案为:硫化钠;Na2S;黄.
(1)B为Na元素,原子核外有3个电子层,最外层电子数为1,则原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)A为S元素,B为Na元素,二者形成的化合物为Na2S,,名称为硫化钠,Na元素的焰色反应为黄色,
故答案为:硫化钠;Na2S;黄.
点评:本题考查原子结构与元素的性质,题目较为简答,注意原子核外电子排布特点.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目