题目内容
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管中增加的水的体积等于_________的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_________(填:“偏高”“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用_________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1。N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为:_________。
(5)将上述装置改为简易实验装置,除导管外还需要选用的仪器为_________(填下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶e.量筒 f.单孔塞 g.双孔塞
解析:由SO2、N2、O2组成的混合气体通入反应管中以后,发生的变化可分为两大项:
一是SO2与I2发生化学反应:SO2+I2+2H2O![]() H2SO4+2HI
H2SO4+2HI
根据化学反应方程式和反应了的I2的物质的量可求得反应了的SO2的体积;如果还有别的氧化剂能快速地氧化SO2,且能明显地反映出化学反应终点的现象试剂,这样的氧化剂可以代替碘的淀粉溶液。
二是未被吸收的气体将液体向右排出。可利用量气管间接地测出未被吸收的气体的体积。
综合上述两项变化,可求得SO2、N2、O2的混合气体中SO2的含量。
在图所示装置中,去掉中间的球形干燥管并无不良影响,左边的反应管还可以用配备双孔塞的试管、烧瓶、广口瓶、锥形瓶等中任意一件代替,右边的量气管可以用量筒代替。
答案:(1)N2、O2 (2)偏低
(3)酸性高锰酸钾溶液(或溴水)
![]()
(5)bceg(或beg或ceg)

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
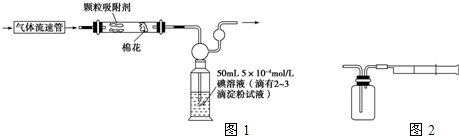

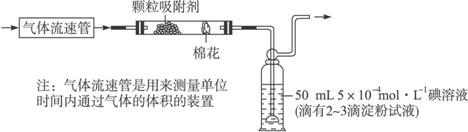

 Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
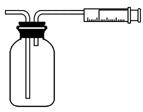
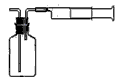
Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量: Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。