题目内容
空气中的SO2含量是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
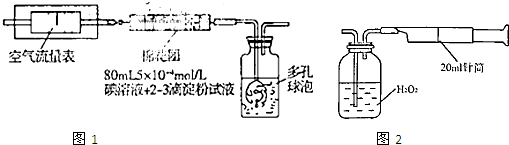
 Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
(1)用上述装置测定空气中的SO2含量依据的化学反应原理是:
▲ (用化学方程式表示)。
(2)应用上述装置测定空气中的SO2含量,除测定气体流速(单位:cm3/min)外,还需要测定的数据是 ▲ 。
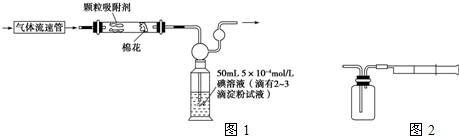
 Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
(3)若乙同学在实验室配制100 mL 5×10-4mol/L的碘溶液,需要用到的玻璃仪器是
▲ 。
(4) 如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,你认为其中可能的原因(假设溶液配制、称量或量取及各种读数均无误)是:
▲ 。
Ⅲ:SO2的排放是造成酸雨的主要因素,丙同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,丙同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
(5)该V L雨水中溶解SO2的体积是 ▲ mL(标准状况)。
(6)若生成沉淀物的质量为4.50 g,该雨水中含有H2SO3的物质的量浓度是多少?
(1)SO2 +I2 +2 H2O =H2SO4 +2HI (2分)
(2) 溶液蓝色恰好褪去所需的时间 (1分)
(3) 100 mL容量瓶、烧杯、玻璃棒、胶头滴管 (2分)
(4) 抽气速度过快或装置气密性较差 (1分)
(5) 448 (2分)
(6) c(H2SO3)=0.01/V mol/L (2分)

当空气受SO2严重污染时,可通过飞机喷洒X粉末,使空气中的SO2含量明显降低,该过程发生的反应是2X +2SO2+O2=2CaSO4 +2CO2。X的化学式是
| A.CaO | B.Na2CO3 | C.Ca(OH)2 | D.CaCO3 |