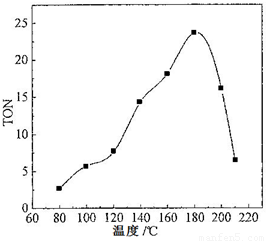
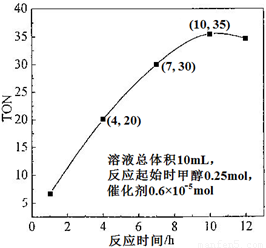
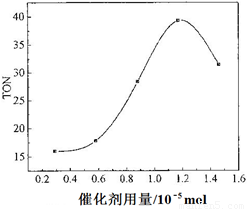
题目内容
碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂。
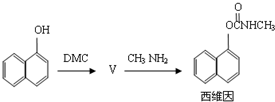
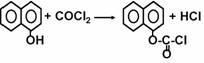
农药西维因过去采用的合成路线如下(反应条件省略)
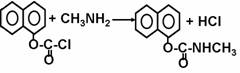
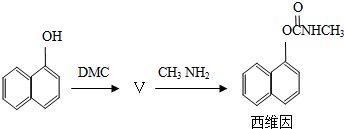
现在采用的合成路线为:
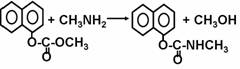
(1)农药西维因的生产工艺中,原生产工艺会产生含有 (只填非金属元素)的废物,并增加生产成本。
(2)新工艺被称为绿色化学工艺的原因是 ; 。
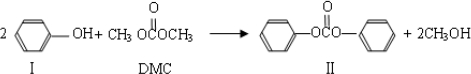
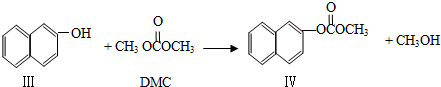
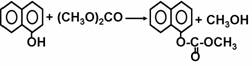
(3)DMC可通过以下方式合成:

①Ⅰ是体现一个国家石油化工水平的标志产品,可用于合成生产食品包装膜的高分子原料,该高分子化合物的化学式是
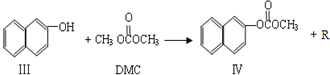
②中间产物Ⅲ属于下列 类物质
A、醛 B、酮 C、羧酸 D、酯
③由Ⅰ生成Ⅱ的反应是原子利用率100%的反应,其化学方程式为 ;
④副产物Ⅳ的结构简式是 ;
⑤有关DMC,下列说法正确的是
A、能与金属钠反应放出氢气 B、水解能产生CO2和甲醇
C、与乙醇互为同分异构体 D、可由卤代烃的取代反应制备 E、可发生酯化反应
练习册系列答案
相关题目
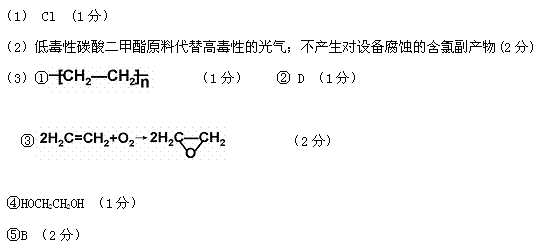

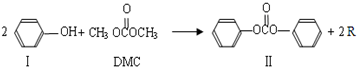
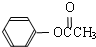 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是