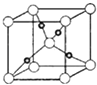
��Ŀ����
����Ŀ����֪��A��B��C��D��E��F�ڳ����¾�Ϊ���壬����������ת����ϵ�����ַ�Ӧ��������������ȥ����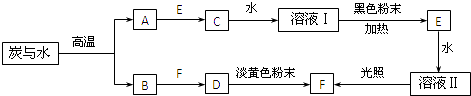
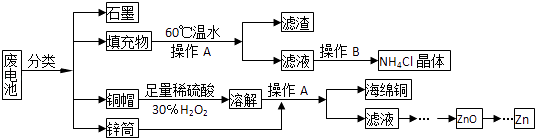
��ش��������⣺
��1����A��ȼ�����뵽װ��E�ļ���ƿ�У��ɹ۲쵽�������� ��
��2��C��Ũ��Һ���ɫ��ĩ��Ӧ����E�Ļ�ѧ����ʽΪ ��
��3��������Һ����뵽�⻯����Һ�У�������Ӧ�����ӷ���ʽΪ �� ��Ӧ�����Һ�м�������CCl4 �� ������ã����Թ۲쵽�������� ��
��4������Һ��Ƚϣ���Һ���ж�������������ѧʽ����
���𰸡�
��1��������ɫ���棬��������������
��2��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��3��Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ
��4��Cl2��HClO
���������⣺̿��ˮ�ڸ���������CO��H2 �� B������F��������D��D�뵭��ɫ��ĩ��Ӧ����F��Ӧ��CO2��Na2O2��Ӧ����̼����������������֪BΪCO��FΪO2 �� DΪCO2 �� ��AΪH2 �� ����E��ˮ��Ӧ�����տɵ�����������֪EΪCl2 �� ��Һ��Ϊ��ˮ�����ת����ϵ��֪��CΪHCl������ˮ����Һ��Ϊ���ᣬŨ�������ɫ��ĩ�������̷�Ӧ�ɵ�����������ת����ϵ����1����������ȼ�����˵�װ�������ļ���ƿ�У������������м���ȼ�գ�������ɫ���棬�������������������Դ��ǣ�������ɫ���棬������������������2��Ũ�������ɫ��ĩ�������̷�Ӧ�����Ȼ�þ��������ˮ����Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����Դ��ǣ�MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O�����Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����3��������ˮ���뵽�⻯����Һ�У������������������ɵⵥ�ʣ�����������Ϊ�����ӣ���Ӧ���ӷ���ʽΪ��Cl2+2I���TI2+2Cl�� �� ��Ӧ�����Һ�м�������CCl4 �� ������ã���ȡ��Һ�еĵ⣬CCl4�ܶȱ�ˮ�����Իῴ��Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ�����Դ��ǣ�Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ����5������ҺIΪ���Ậ�У�H2O��H+��Cl�� �� ��Һ��Ϊ��ˮ������H2O��Cl2��HClO��H+��Cl�� �� ��ҺII�ж����������Cl2��HClO�����Դ��ǣ�Cl2��HClO��
MnCl2+Cl2��+2H2O����3��������ˮ���뵽�⻯����Һ�У������������������ɵⵥ�ʣ�����������Ϊ�����ӣ���Ӧ���ӷ���ʽΪ��Cl2+2I���TI2+2Cl�� �� ��Ӧ�����Һ�м�������CCl4 �� ������ã���ȡ��Һ�еĵ⣬CCl4�ܶȱ�ˮ�����Իῴ��Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ�����Դ��ǣ�Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ����5������ҺIΪ���Ậ�У�H2O��H+��Cl�� �� ��Һ��Ϊ��ˮ������H2O��Cl2��HClO��H+��Cl�� �� ��ҺII�ж����������Cl2��HClO�����Դ��ǣ�Cl2��HClO��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�