��Ŀ����
����Ŀ�������������
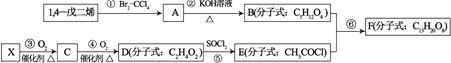
��I��������һ�������¿�������������
A��̼�����ӣ�CH3+ �� B��̼�����ӣ�CH3���� C���� ����CH3�� D��̼ϩ����CH2��
���������У�����Ϊ120�����������ţ���
��̼�����ӣ�CH3�����Ŀռ乹��Ϊ �� ��CH3����Ϊ�ȵ������һ�ַ��������ѧʽ����
��II ������ȡ�ϳɰ�ԭ�����Ĺ����У�������һЩ���ʣ���CO��ʹ�����ж�����ȥCO�Ļ�ѧ����ʽΪ��HAc��ʾ���ᣩ��Cu��NH3��2Ac+CO+NH3=Cu��NH3��3��CO��Ac����ش��������⣺
��C��N��O�ĵ縺���ɴ�С��˳��Ϊ ��
��д��Cu�ĺ�������Ų�ʽ ��
�ۻ�����Cu��NH3��3��CO��Ac�У�����Ԫ�صĻ��ϼ�Ϊ ��
����һ��������NH3��CO2�ܺϳ�����CO��NH2��2 �� ������Cԭ�ӹ�����ӻ�����Ϊ��1mol���ط����У��� ������ĿΪ ��
��Cu2O����ľ����ṹ��ͼ��ʾ��������٤������ΪNA �� �����ı߳�Ϊapm��������ܶ�Ϊgcm��3 �� 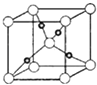
���𰸡�A�������Σ�NH3��O��N��C��1s22s22p63s23p63d104s1��[Ar]3d104s1��+1��sp2��7NA��![]()
���������⣺��I�� ��A��̼�����ӣ�CH3+������3���Ҽ���û�йµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp2 �� Ϊƽ�������νṹ������Ϊ120�㣬��A��ȷ��
B��̼�����ӣ�CH3��������3���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ������Ϊ����120�㣬��B����
C��������CH3������3���Ҽ���1���µ��ӣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ������Ϊ����120�㣬��C����
D��̼ϩ����CH2������2���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp2 �� Ϊƽ�������νṹ�����ڹµ��ӶԳ�������Ϊ����120�㣬��D����
���Դ��ǣ�A����̼�����ӣ�CH3��������3���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ��CH3��ԭ�Ӹ���Ϊ4���۵�����Ϊ8������CH3����Ϊ�ȵ������һ�ַ�����NH3 �� ���Դ��ǣ������Σ�NH3����II ����ͬ���ڴ����ҵ縺��Խ��Խ������C��N��O�ĵ縺���ɴ�С��˳��ΪO��N��C�����Դ��ǣ�O��N��C����ͭԭ����29�ţ����ݹ���ԭ��д����������Ų�Ϊ1s22s22p63s23p63d104 s1��[Ar]3d104 s1 �� ���Դ��ǣ�1s22s22p63s23p63d104 s1��[Ar]3d104 s1����Ac����ʾ�����������������嶼�Ƿ��ӣ������磬����ͭ�Ļ��ϼ�Ϊ+1�ۣ����Դ��ǣ�+1��������ԭ��Ϊ̼�������1����ԭ�ӣ�2����ԭ�ӣ���C�¶Ե��ӣ����Լ۲���Ӷ�Ϊ3�ԣ����ӻ����Ϊsp2��ÿ��̼�ĦҼ�Ϊ3����ÿ���ǰ����ЦҼ�����Ŀ2��һ���������к��Ҽ�����ĿΪ3+2��2=7����ÿĦ�������к��ЦҼ�����ĿΪ7NA �� ���Դ��ǣ�sp2��7NA��
��Oԭ���ھ����Ķ�������ģ���Oԭ����=8�� ![]() +1=2��Cuԭ��ȫ�������ģ���Cuԭ����=4����һ��������ͭ��������2��Oԭ�Ӻ�4��Cuԭ�ӣ���2��Cu2O�������������ܶȦ�=
+1=2��Cuԭ��ȫ�������ģ���Cuԭ����=4����һ��������ͭ��������2��Oԭ�Ӻ�4��Cuԭ�ӣ���2��Cu2O�������������ܶȦ�= ![]() =
= ![]() =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��