题目内容
(2009?湛江二模)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石.有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺.该工艺流程如图所示:
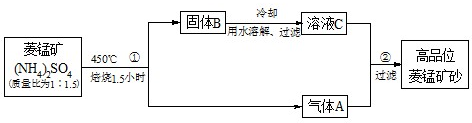
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3
MnSO4+2NH3↑+CO2↑+H2O.
(1)写出反应②的离子方程式
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是
=

已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3
| ||
(1)写出反应②的离子方程式
Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓
Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓
.(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、
NH3
NH3
、CO2
CO2
.从物料平衡角度看,理论上生产过程中不需要
不需要
(填“需要”或者“不需要”)添加(NH4)2SO4.(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是
Mn2+
Mn2+
(填离子符号);当两种沉淀共存时,溶液中| c(Ba2+) |
| c(Mn2+) |
450
450
[Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11].分析:(1)写出反应②是锰离子与氨气、二氧化碳反应生成碳酸锰沉淀;
(2)焙烧菱锰矿得到了气体A,成分是氨气和二氧化碳,氨气和二氧化碳能够与锰离子反应生成碳酸锰,可以循环利用;由于反应后有生成了硫酸铵,所以理论上不需要添加硫酸铵;
(3)难溶物的溶度积常数越小的,该金属离子先沉淀;当两种难溶电解质共存时,碳酸锰恰好饱和,溶液中锰离子浓度和碳酸根离子浓度相等,根据碳酸锰的溶度积常数计算锰离子、碳酸根离子浓度,再根据碳酸钡溶度积常数、碳酸根离子浓度计算钡离子浓度,从而得出钡离子和锰离子浓度之比.
(2)焙烧菱锰矿得到了气体A,成分是氨气和二氧化碳,氨气和二氧化碳能够与锰离子反应生成碳酸锰,可以循环利用;由于反应后有生成了硫酸铵,所以理论上不需要添加硫酸铵;
(3)难溶物的溶度积常数越小的,该金属离子先沉淀;当两种难溶电解质共存时,碳酸锰恰好饱和,溶液中锰离子浓度和碳酸根离子浓度相等,根据碳酸锰的溶度积常数计算锰离子、碳酸根离子浓度,再根据碳酸钡溶度积常数、碳酸根离子浓度计算钡离子浓度,从而得出钡离子和锰离子浓度之比.
解答:解:(1)溶液C中的锰离子与气体A中的氨气、二氧化碳反应生成碳酸锰沉淀,反应的化学方程式为:Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓,
故答案啊为:Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓;
(2)由于焙烧菱锰矿得到了气体A,成分是氨气和二氧化碳,氨气和二氧化碳能够与锰离子反应生成碳酸锰,可以循环利用;由于反应后有生成了硫酸铵,所以理论上不需要添加硫酸铵,
故答案为:NH3、CO2; 不需要;
(3)碳酸钡的溶度积常数大于碳酸锰的溶度积常数,所以锰离子先沉淀;当两种难溶电解质共存时,则
c(CO32-)=c(Mn2+)=
,溶液中c(Ba2+)=
:,c(Ba2+):c(Mn2+)=
:
=450,
故答案为:Mn2+;450.
故答案啊为:Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓;
(2)由于焙烧菱锰矿得到了气体A,成分是氨气和二氧化碳,氨气和二氧化碳能够与锰离子反应生成碳酸锰,可以循环利用;由于反应后有生成了硫酸铵,所以理论上不需要添加硫酸铵,
故答案为:NH3、CO2; 不需要;
(3)碳酸钡的溶度积常数大于碳酸锰的溶度积常数,所以锰离子先沉淀;当两种难溶电解质共存时,则
c(CO32-)=c(Mn2+)=
| 1.8×10-11 |
| 8.1×10-9 | ||
|
| 8.1×10-9 | ||
|
| 1.8×10-11 |
故答案为:Mn2+;450.
点评:本题考查了物质制备实验方案的流程分析和产物判断,注意合理分析题中信息,了解生产流程,根据所学知识完成,本题难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).