题目内容
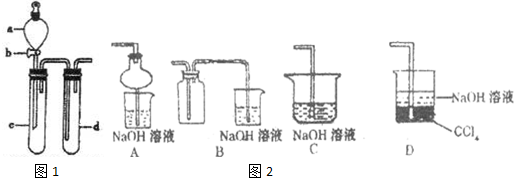
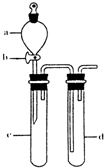
SO2 是一种重要的化工原料,某兴趣小组采用如图1所示装置制取并探究SO2气体的性质.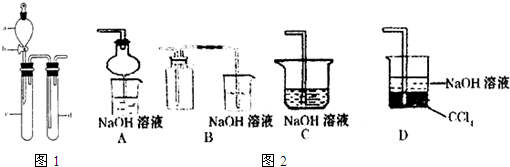
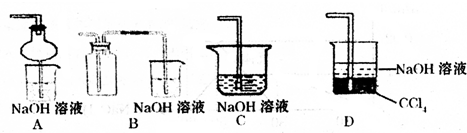
(1)下列实验方案适用于用如图所示装置制取所需SO2 的是
A.Na2SO3 溶液与HNO3
B.Na2SO3 固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与浓H2SO4
(2)组装完仪器后,检查发生装置气密性的方法是:关闭活塞b,
(3)指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2所示装置,其中合理的是
(4)小组同学设计在试管d中加入FeCl3溶液,验证SO2 的还原性.为了验证SO2 与Fe3+发生了氧化还原反应,他们在通入足量SO2 后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KMnO4 溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
写出SO2 与Fe3+反应的离子方程式
上述方案中不合理的一项是

(1)下列实验方案适用于用如图所示装置制取所需SO2 的是
B
B
(填序号).A.Na2SO3 溶液与HNO3
B.Na2SO3 固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与浓H2SO4
(2)组装完仪器后,检查发生装置气密性的方法是:关闭活塞b,
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
;(3)指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2所示装置,其中合理的是
AD
AD
(填序号).(4)小组同学设计在试管d中加入FeCl3溶液,验证SO2 的还原性.为了验证SO2 与Fe3+发生了氧化还原反应,他们在通入足量SO2 后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KMnO4 溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
写出SO2 与Fe3+反应的离子方程式
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
.上述方案中不合理的一项是
A
A
,原因是因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
.分析:(1)实验室用Na2SO3 固体与浓硫酸反应制备二氧化硫气体;
(2)检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升;
(3)尾气吸收装置应考虑倒吸;
(4)检验Fe2+,应排除其它物质的干扰.
(2)检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升;
(3)尾气吸收装置应考虑倒吸;
(4)检验Fe2+,应排除其它物质的干扰.
解答:解:(1)实验室用Na2SO3 固体与浓硫酸反应制备二氧化硫气体,而如图所示装置没有加热,则不能用浓硫酸和铜反应制备,故答案为:B;
(2)检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升,具体操作为试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好,
故答案为:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好;
(3)二氧化硫易溶于水,尾气吸收装置应防止倒吸,可用AD,故答案为:AD;
(4)SO2具有还原性,Fe3+具有氧化性,二者可发生氧化还原反应,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
方案A:往第一份试液中加入KMnO4 溶液,紫红色褪去,不能证明,因因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成;
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红,说明有Fe2+生成;
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀,说明有生成SO42-.
则B、C都可证明SO2 与Fe3+发生了氧化还原反应,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;A;因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成.
(2)检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升,具体操作为试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好,
故答案为:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好;
(3)二氧化硫易溶于水,尾气吸收装置应防止倒吸,可用AD,故答案为:AD;
(4)SO2具有还原性,Fe3+具有氧化性,二者可发生氧化还原反应,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
方案A:往第一份试液中加入KMnO4 溶液,紫红色褪去,不能证明,因因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成;
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红,说明有Fe2+生成;
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀,说明有生成SO42-.
则B、C都可证明SO2 与Fe3+发生了氧化还原反应,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;A;因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成.
点评:本题考查的是二氧化硫的性质及实验室制法,二氧化硫有还原性,与强氧化剂发生氧化还原反应,还具有漂白性,经常与次氯酸的漂白性比较,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.