题目内容
17.下列各组混合物,可用溶解、过滤的方法加以分离的是( )| A. | 硝酸钾和氯化钠 | B. | 硫酸钡和碳酸钡 | C. | 碳酸钠和碳酸钙 | D. | 氧化镁和氧化铝 |
分析 用溶解、过滤的方法加以分离,则两种物质中只有一种不溶于水,以此来解答.
解答 解:A.均溶于水,不能过滤分离,故A不选;
B.均不溶于水,不能过滤分离,故B不选;
C.碳酸钙不溶于水,碳酸钠溶于水,则溶解、过滤可分离,故C选;
D.均不溶于水,不能过滤分离,故D不选;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与应用能力的考查,注意常见物质的溶解性,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.下列实验操作或现象解释不正确的是( )
| A. | 进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 读取滴定管内液体体积时,俯视读数导致读数偏小 | |
| D. | 利用一束强光照射明矾水溶液,产生光亮的“通路”,说明明矾一定发生了水解 |
5.一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1,.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)<v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
12.高温下,某可逆反应达到平衡,其平衡常数为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
| A. | 该反应的焓变为正值 | |
| B. | 升高温度,K值减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的化学方程式为CO(g)+H2O(g)?CO2(g)+H2(g) |
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
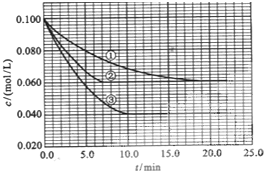 在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.
在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.