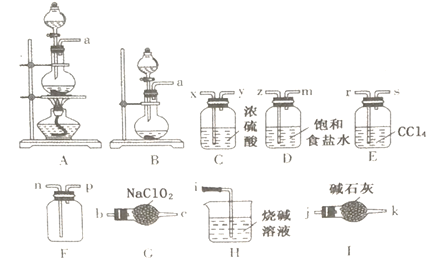
题目内容
【题目】如图所示三套实验装置,分别回答下列问题. 
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观
察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1
的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附
近首先变红.
①烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
【答案】
(1)O2+4e﹣+2H2O﹣═4OH﹣
(2)负;Fe3++e﹣=Fe2+
(3)阳;2H++2e﹣═H2;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;224
2Cu+O2↑+4H+;224
【解析】解:(1.)铁发生吸氧腐蚀,正极发生还原反应,氧气得到电子被还原生成OH﹣ , 电极方程式为O2+4e﹣+2H2O﹣═4OH﹣ , 所以答案是:O2+4e﹣+2H2O﹣═4OH﹣;
(2.)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+ , 形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e﹣=Fe2+ , 所以答案是:负; Fe3++e﹣=Fe2+;
(3.)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH﹣ , 应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e﹣═H2 , 所以答案是:阳; 2H2O+2e ﹣=H2↑+2OH﹣或2H++2e﹣═H2;
②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O ![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 ![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O | + | 2e﹣ | ═ | 2OH﹣ | + | H2↑ |
2mol | 22.4L | |||||
0.02mol | V |
V= ![]() =0.224L,即224mL,所以答案是:224.
=0.224L,即224mL,所以答案是:224.

【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为mL.![]()
(4)滴定.当时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
经计算,市售白醋总酸量=g/100mL.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.