题目内容
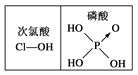
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点 A2D<A2X
B. CA3 分子是非极性分子
C. B、C、D 形成的气态氢化物互为等电子体
D. C 形成的常见单质中 σ 键与 π 键个数之比为 1:2
【答案】D
【解析】由元素在周期表中的位置可知,A为氢元素,B为碳元素,C为氮元素,D为氧元素,X为硫元素,Y为Cl元素。A.水分子之间存在氢键,沸点较高,常温下为液体,硫化氢为气态,故A错误;B.NH3分子是三角锥型结构,正负电荷重心不重合,属于极性分子,故B错误;C.甲烷、氨气、水分子中都含10个电子,但原子数目不相等,不是等电子体,故C错误;D.氮气分子中存在N≡N三键,三键含有1个σ键、2个π键,分子中σ与π之比为1:2,故D正确;故选D。

【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
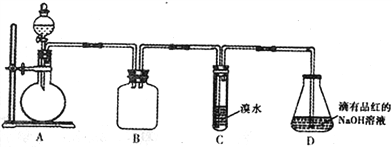
(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。
【题目】新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。 磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
【方法一】 将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
【方法二】 将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
【方法三】 以铁红、锂辉石LiAl (SiO3)2 (含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
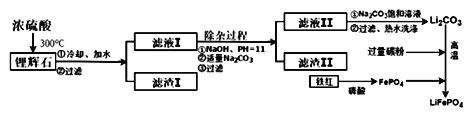
己知: 2LiAl (SiO3) 2+ H2SO4(浓)=Li2SO4+ Al2O3·4SiO2·H2O↓
溶解度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4) /g | 34.2 | 32.8 | 31.9 | 30.5 |
(1) 在方法一中,阳极生成磷酸亚铁锂的电极反应式为______________________________。
(2)在方法二中,除生成磷酸亚铁锂、乙酸外,还有H2O、________(填化学式)生成。
(3)方法一与方法二中,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是________________。
(4)在方法三中从滤渣I中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式________________。
![]()
(5)向滤液II中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___________________________。(6) 写出在高温下生成磷酸亚铁锂的化学方程式______________________________________。
(7)磷酸铁锂锋动力电池(简称LFP) 是一种高效、超长寿命的二次电池。其工作原理为:
C6Li+FePO4![]() C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。