题目内容
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题。
(1)天然水中溶解的气体主要有________、________;
(2)天然水在净化处理过程中加入的混凝剂可以是 ____________其净水作用的原理是________________________________________________________________;
(3)水的净化与软化的区别是____________________________________________
(4)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3 mol·L-1,c(Mg2+)=6×10-4 mol·L-1,则此水的硬度为________;
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4 mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2________ g,后加入Na2CO3________g。
(1)O2 CO2(或氮气)
(2)明矾、硫酸铝、硫酸铁、硫酸亚铁(任选两种) 铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化的目的
(3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子
(4)10°
(5)740 1 484
【解析】(1)天然水中溶解的气体主要是空气,空气由N2、O2、CO2、H2O等气体组成。
(2)混凝剂的作用是净化水,即除去水中悬浮的杂质,能作混凝剂的物质为Fe3+盐或Al3+盐,其净水原理是应用Al3+(或Fe3+)的水解,Al3++3H2O??Al(OH)3(胶体)+3H+,Fe3++3H2O??Fe(OH)3(胶体)+3H+,由于生成的胶体中胶粒有较大的比表面积,可以吸附水中的悬浮物,并且金属氢氧化物形成的胶粒吸附阳离子后带正电荷,破坏天然水中其他带异电的胶体,达到净水的目的。
(3)水的软化是降低其中Ca2+、Mg2+的含量,含较多Ca2+、Mg2+的水叫做硬水,不含或含较少Ca2+、Mg2+的水叫做软水。
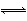
(4)取1 L该硬水,其中n(Ca2+)=1.2×10-3 mol,m(CaO)=1.2×10-3 mol×56 g·mol-1=6.72×10-2 g,则由CaO引起的硬度为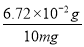 =6.72°,该硬水中n(Mg2+)=6×10-4 mol,m(MgO)=6×10-4 mol×40 g·mol-1=2.4×10-2 g,则由MgO引起的硬度为
=6.72°,该硬水中n(Mg2+)=6×10-4 mol,m(MgO)=6×10-4 mol×40 g·mol-1=2.4×10-2 g,则由MgO引起的硬度为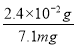 =3.38°,则此水的硬度为6.72°+3.38°=10.1°,约为10°。
=3.38°,则此水的硬度为6.72°+3.38°=10.1°,约为10°。
(5)10 m3天然水中,n(Ca2+)=1.2×10-3 mol·L-1×10 m3×1 000 L·m-3=12 mol,n(Mg2+)=6×10-4 mol·L-1×10 m3×1 000 L·m-3=6 mol,n(HCO3-)=8×10-4 mol·L-1×10 m3×1 000 L·m-3=8 mol,应用石灰纯碱法软化硬水生成的沉淀为Mg(OH)2和CaCO3,其中发生的离子反应方程式为HCO3-+OH-=CO32-+H2O,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,设加入Ca(OH)2的物质的量为x,Na2CO3的物质的量为y,则反应体系中n(Ca2+)=12 mol+x,n(OH-)=2x,n(CO32-)=8 mol+y,可得如下方程组
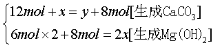
求得x=10 mol,y=14 mol,所以m[Ca(OH)2]=10 mol×74 g·mol-1=740 g,m(Na2CO3)=14 mol×106 g·mol-1=1 484 g。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。