题目内容
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJ?mol-1
下列表述正确的是(NA代表阿伏伽德罗常数的数值) ( )
| A.1molCO燃烧时放出的热量为283 kJ?mol-1 |
| B.Na2O2(s)+CO(g) = Na2CO3(s)ΔH= -509 kJ?mol-1 |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
B
解析试题分析:A.根据燃烧的方程式可知1molCO燃烧时放出的热量为283 kJ,错误;B.①÷2+②,整理可得:Na2O2(s)+CO(g) = Na2CO3(s) ΔH= -509 kJ/mol;正确;C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为NA,错误;D.Na2O2和Na2CO3中阴阳离子个数比相同,都是2:1,错误。
考点:考查盖斯定律的应用、热化学方程式的书写的知识。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案下面有关晶体的叙述中,错误的是( )
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
Ⅰ下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.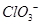 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和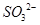 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,
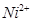 和
和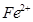 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;

(5)丁二酮肟常用于检验
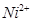 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与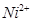 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.Δ H3=ΔH1+2ΔH2 | B.Δ H3=ΔH1+ΔH2 |
| C.Δ H3=ΔH1-2ΔH2 | D.Δ H3=ΔH1-ΔH2 |
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为: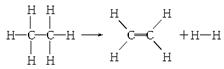
若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
已知2H2(g)+O2(g)= 2H2O(l) ΔH=-569.6 kJ·mol-1, 2H2O(g)= 2H2(g)+O2(g) ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43 kJ | B.4.86 kJ | C.43.8 kJ | D.87.5 kJ |
下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
| A.③④ | B.②③ | C.①④⑤ | D.②④ |