题目内容
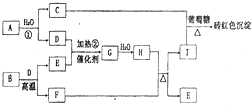 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,单质F可与H的浓溶液加热时发生反应.请回答下列问题:
(1)写出G的化学式:
SO3
SO3
;(2)反应①的离子方程式为
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;(3)单质F与H的浓溶液发生反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;
| ||
(4)用Pt作电极电解I溶液,完全电解后的电解质溶液是
H2SO4
H2SO4
,其阳极的电极反应式为4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(5)已知每16g E与D完全反应,放出24.75kJ热量,则反应②的热化学方程式为
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1
;(6)工业制备G时,混合气体的组成中E占7%、D占11%,现有100体积混合气体进入反应装置,导出的气体恢复到原温度和压强后变为97.2体积,则E的转化率为
80%
80%
.分析:C+I+葡萄糖
砖红色沉淀,故C+I生成Cu(OH)2,且碱过量,故C、I为铜盐和碱,由反应①A+H2O→D+C,D为气体单质,故A为Na2O2,D为O2,C为Cu(OH)2,所以I为铜盐;
D、E常温下为气体,I为铜盐,由反应②O2+E→G
H,H不含Cu元素,结合H+F→I+E,F为单质,故F为金属Cu,E为气体,考虑Cu与酸的反应,故H为酸(浓硫酸或浓硝酸),B为某金屑矿的主要成分,由B
Cu+E,可知B为Cu2S,E为SO2,故G为SO3,H为H2SO4,I为CuSO4,验证符合转化关系.
| △ |
D、E常温下为气体,I为铜盐,由反应②O2+E→G
| H2O |
| O2 |
解答:解:C+I+葡萄糖
砖红色沉淀,故C+I生成Cu(OH)2,且碱过量,故C、I为铜盐和碱,由反应①A+H2O→D+C,D为气体单质,故A为Na2O2,D为O2,C为Cu(OH)2,所以I为铜盐;
D、E常温下为气体,I为铜盐,由反应②D+E→G
H,H不含Cu元素,结合H+F→I+E,F为单质,故F为金属Cu,E为气体,考虑Cu与酸的反应,故H为酸(浓硫酸或浓硝酸),B为某金屑矿的主要成分,由B
Cu+E,可知B为Cu2S,E为SO2,故G为SO3,H为H2SO4,I为CuSO4,验证符合转化关系,
(1)由上述分析可知,G为SO3,故答案为:SO3;
(2)反应①是过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)Cu与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫与水,反应方程式为为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(4)用Pt作电极电解CuSO4溶液,阳离子Cu2+放电,阴离子OH-放电,电解反应方程式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,完全电解后为电解质溶液是H2SO4溶液,OH-在阳极放电生成氧气,阳极的电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:H2SO4;4OH--4e-=2H2O+O2↑;
(5)16gSO2的物质的量为
=0.25mol,与O2完全反应,放出24.75kJ热量完全反应,2mol完全反应放出的热量为24.75kJ×
=198kJ,
则反应②的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1;
(6)混合气体SO2的体积为:100体积×7%=7体积,
令参加反应的SO2体积为x,则:
2SO2(g)+O2(g)?2SO3 (g)体积减少△V
2 1
x 100体积-97.2体积=2.8体积
解得x=2.8体积×2=5.6体积,
则转化率为
×100%=80%,故答案为:80%.
| △ |
D、E常温下为气体,I为铜盐,由反应②D+E→G
| H2O |
| O2 |
(1)由上述分析可知,G为SO3,故答案为:SO3;
(2)反应①是过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)Cu与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫与水,反应方程式为为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)用Pt作电极电解CuSO4溶液,阳离子Cu2+放电,阴离子OH-放电,电解反应方程式为:2CuSO4+2H2O
| ||
(5)16gSO2的物质的量为
| 16g |
| 64g/mol |
| 2mol |
| 0.25mol |
则反应②的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1;
(6)混合气体SO2的体积为:100体积×7%=7体积,
令参加反应的SO2体积为x,则:
2SO2(g)+O2(g)?2SO3 (g)体积减少△V
2 1
x 100体积-97.2体积=2.8体积
解得x=2.8体积×2=5.6体积,
则转化率为
| 5.6体积 |
| 7体积 |
点评:本题以无机框图题的形式考查Cu、S、Na等元素单质及其化合物之间的相互转化关系和逻辑推理能力、热化学方程式等化学用语的书写、电解池、化学平衡的有关计算等,难度较大,C+I+葡萄糖
砖红色沉淀是解题突破口,利用逻辑推理推出C、I,再结合转化关系与倒推法进行推理,B到E、F的转化是学生的未知知识,利用氧化还原反应知识进行推理,对学生的逻辑推理能力提出较高要求.
| △ |

练习册系列答案
相关题目
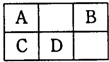 (2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( )
(2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( )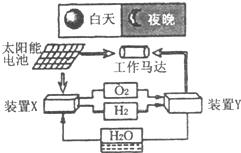 (2011?郑州二模)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
(2011?郑州二模)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )