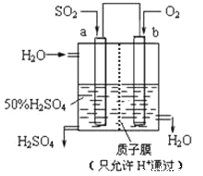
题目内容
【题目】常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。下列说法不正确的是
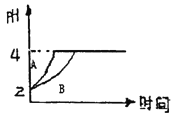
A. 图中表示醋酸溶液中pH变化曲线的是B
B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,则m1<m2
C. pH=2时盐酸和醋酸的物质的量前者小
D. pH=4时两溶液c(Zn2+)相等
【答案】D
【解析】A、反应过程中醋酸电离出氢离子,所以反应过程中醋酸中c(H+)大于HCl,pH小,图中表示醋酸溶液中pH变化曲线的是B,故A正确;B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,醋酸中消耗n(H+)大于盐酸,消耗氢离子的物质的量与消耗锌的质量成正比,所以消耗锌的质量m1<m2,则m1<m2,故B正确;C.醋酸是弱电解质,难电离, pH=2时盐酸和醋酸的物质的量前者小,故C正确;D、根据电荷守恒:2c(Zn2+)+c(H+) =c(Cl-)+c(OH-),2c(Zn2+)+c(H+) =c(CH3COO-)+c(OH-),pH=4时,两溶液中c(Cl-)和c(CH3COO-)不相等,两溶液c(Zn2+)不相等,故D错误;故选D。

【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为放热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)>c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1