题目内容
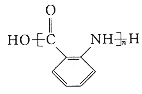
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
【答案】第二周期VA族NH3先通NH3,后通CO2NH4Cl(s)![]() NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出NH3+HCl=NH4ClMgO+2NH4Cl
NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出NH3+HCl=NH4ClMgO+2NH4Cl![]() 2NH3↑+MgCl2+H2O↑
2NH3↑+MgCl2+H2O↑
【解析】
(1)N的原子序数是7,在元素周期表中的位置是第二周期ⅤA族;氮元素非金属性强于碳元素,非金属性越强,氢化物越稳定,则稳定性是NH3的稳定性更强;
Ⅰ. (1)氨气极易溶于水,CO2在水中的溶解度很小,因此过程i要首先通入NH3,然后再通入CO2。
(2) 过程ii中NH4Cl(s)![]() NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出,故使NH4Cl析出;
NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出,故使NH4Cl析出;
(3)加热分解NH4Cl生成的NH3和HCl冷却后又转化为氯化铵,从而得不到氨气,方程式为NH3+HCl===NH4Cl。而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,根据原子守恒可知还有氯化镁和水生成,该反应的化学方程式为MgO+2NH4Cl![]() 2NH3↑+MgCl2+H2O↑。
2NH3↑+MgCl2+H2O↑。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
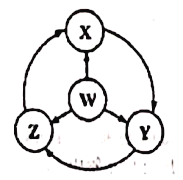
选项 | W | X | Y | Z |
A | Fe | Fe(OH)2 | FeCl3 | FeCl2 |
B | Na | Na202 | NaOH | NaCl |
C | S | SO2 | SO3 | H2SO4 |
D | A1 | AlCl3 | NaAlO2 | Al2(SO4)3 |
A. A B. B C. C D. D