题目内容
NaNO3 KNO3 NaCl KCl
10℃ 80.5 20.9 35.7 31.0
100℃ 175 246 39.1 56.6
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4 g NaCl和40.4 g KNO3,加70.0 g H2O,加热溶解。在100℃时蒸发掉 50.0 g H2O,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温)。
将滤液冷却至10 ℃,待充分结晶后过滤。计算所得晶体的质量(m低温)。
(2)另取34.0gNaNO3和29.8 g KCl,同样进行如上实验。10℃时析出的晶体是_______________(写化学式)。100℃和10℃得到的晶体质量(m′高温和m′低温)分别是多少?
(1)15.6 g 36.9 g (2)15.6 g 36.9 g
(1)100℃时S (NaCl)最小,所以析出NaCl晶体,则不析出KCl、NaNO3;KNO3溶液未达饱和,亦不会析出。
m高温=23.4 g-39.1 g×(70.0 g-50.0 g)÷100 g
=23.4 g-7.82 g
=15.6 g
将溶液冷却到10℃,析出晶体为KNO3和NaCl,析出KNO3晶体质量为:
40.4 g-20.9 g×(70.0g-50.0 g)÷100 g
=40.4 g-4.18 g
="36.2" g
析出NaCl晶体的质量为:(39.1 g-35.7 g)×(70.0 g-50.0 g)÷100 g="0.68" g
则:m低温="0.68" g+36.2 g="36.9" g
(2)两种原始溶液中,各种盐的物质的量都相等。
n(NaCl)= =n(KNO3)=
=n(KNO3)=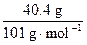 =n(NaNO3)
=n(NaNO3)
= =n(KCl)=
=n(KCl)= ="0.400" mol。
="0.400" mol。
因而溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据可知,100℃时蒸发后得到的是NaCl晶体,冷却后得到的是KNO3晶体,但也含有少量的NaCl。所以第(2)小题不必再计算,便知:
m′高温=m高温="15.6" g m′低温=m低温="36.9" g
m高温=23.4 g-39.1 g×(70.0 g-50.0 g)÷100 g
=23.4 g-7.82 g
=15.6 g
将溶液冷却到10℃,析出晶体为KNO3和NaCl,析出KNO3晶体质量为:
40.4 g-20.9 g×(70.0g-50.0 g)÷100 g
=40.4 g-4.18 g
="36.2" g
析出NaCl晶体的质量为:(39.1 g-35.7 g)×(70.0 g-50.0 g)÷100 g="0.68" g
则:m低温="0.68" g+36.2 g="36.9" g
(2)两种原始溶液中,各种盐的物质的量都相等。
n(NaCl)=
 =n(KNO3)=
=n(KNO3)=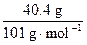 =n(NaNO3)
=n(NaNO3)=
 =n(KCl)=
=n(KCl)= ="0.400" mol。
="0.400" mol。因而溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据可知,100℃时蒸发后得到的是NaCl晶体,冷却后得到的是KNO3晶体,但也含有少量的NaCl。所以第(2)小题不必再计算,便知:
m′高温=m高温="15.6" g m′低温=m低温="36.9" g

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
 AgI(s) + Cl-
AgI(s) + Cl-