题目内容
下列实验操作与实验目的不一致的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向某钾盐溶液中加入澄清石灰水 | 证明该钾盐是K2CO3 |
| B | 测定0.1mol/L醋酸溶液的pH | 证明醋酸在水溶液中部分电离 |
| C | 向试管中加入相同体积的浓度为0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再加入几滴饱和FeCl3溶液 | 证明增大反应物浓度,平衡向正反应方向移动 |
| D | 向试管a中加入1mL甲苯,向试管b中加入1mL苯,再分别向其中加入几滴KMnO4酸性溶液 | 证明甲苯中苯环使甲基的活性增强 |
分析:A.不一定含有K2CO3,也可能为K2SO3或KHCO3等;
B.醋酸为弱酸,不能完全电离;
C.根据反应Fe3++3SCN-?Fe(SCN)3判断;
D.甲苯可与酸性高锰酸钾发生氧化还原反应.
B.醋酸为弱酸,不能完全电离;
C.根据反应Fe3++3SCN-?Fe(SCN)3判断;
D.甲苯可与酸性高锰酸钾发生氧化还原反应.
解答:解:A.不一定含有K2CO3,也可能为K2SO3或KHCO3等,都可与澄清石灰水反应生成沉淀,故A错误;
B.醋酸为弱酸,不能完全电离,根据溶液的pH可判断是否若电解质,故B正确;
C.Fe3++3SCN-?Fe(SCN)3为可逆反应,增大反应物浓度,平衡向正方向移动,故C正确;
D.甲苯可与酸性高锰酸钾发生氧化还原反应,而与苯不反应,可证明甲苯中苯环使甲基的活性增强,故D正确.
故选A.
B.醋酸为弱酸,不能完全电离,根据溶液的pH可判断是否若电解质,故B正确;
C.Fe3++3SCN-?Fe(SCN)3为可逆反应,增大反应物浓度,平衡向正方向移动,故C正确;
D.甲苯可与酸性高锰酸钾发生氧化还原反应,而与苯不反应,可证明甲苯中苯环使甲基的活性增强,故D正确.
故选A.
点评:本题考查较为综合,侧重于物质的性质实验的探究和比较,注重于学生实验方案的评价能力的考查,题目难度不大,注意把握实验方法和相关物质的性质.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示: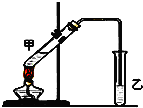 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:



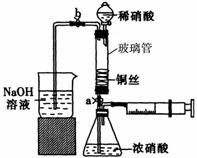 Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。