题目内容
(14分)(1)质量都是50g的HCl、NH3、CO2、O2四种气体中,含分子数最少的是 ;在同温同压下,密度最小的是 (填分子式)。
(2)在 mL0.2 mol/LNaOH溶液中含1g溶质;配制50mL0.2 mol/LCuSO4溶液,需要CuSO4.5H2O g。
(3) 标准状况下,33.6LHCI气体溶于水配成1L溶液,则溶液中溶质的物质的量浓度为 mol/L。
(4)质量分数为49%的硫酸溶液,其密度为1.4g/cm3,则其物质的量浓度为 mol/L。
(5)有一种气体的质量是14.2g,在标准状况下的体积是4.48L,则该气体的摩尔质量为 g/mol。
(1)CO2;NH3 (2)125 mL; 2.5g (3) 1.5mol/L (4)7mol/L (5)71g/mol。
解析试题分析:(1)质量相同时,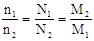 ,CO2的摩尔质量最大,所以分子数最少。
,CO2的摩尔质量最大,所以分子数最少。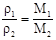 ,NH3的摩尔质量最小,所以密度最小。
,NH3的摩尔质量最小,所以密度最小。
(2)根据n=cV可得V=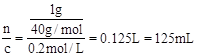 。m=0.05L×0.2mol/L×250g/mol=2.5g。
。m=0.05L×0.2mol/L×250g/mol=2.5g。
(3)c=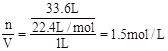 。
。
(4)c=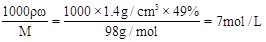 。
。
(5)M=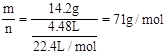 。
。
考点:物质的量计算
点评:本题非常基础简单,主要考查物质的量的基本公式计算。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案(14分)现有前20号的A、B、C、D、E五种元素,相关信息于下表:
| 元素 | 信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | B原子得一个电子后2p轨道全满 |
| C | C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大 |
| D | D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数 |
| E | E+和B- 具有相同的电子层结构 具有相同的电子层结构 |
(2)B、C、D三元素的电负性大小顺序为________>________>________(填元素符号)。
(3)C的氢化物的空间构型为________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是______________________________________________________。
(4)E2D的水溶液呈 (填“酸性”、“碱性”或“中性”),用离子方程式解释理由:_______________________。
(5)已知:12.8 g液态C2 A4与足量A2O2反应生成C2和气态A2O,放出256.65 kJ的热量。
A2O (l)=== A2O (g) ΔH=+44 kJ·mol-1。
2 A2O2 (l)===2A2O (l)+O2(g) ΔH=-196.4 kJ·mol-1。
则液态C2 A4与足量O2反应生成C2和液态A2O的热化学方程式为: ________________________________________________。
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
 CuO
CuO Cu(NO3)2
Cu(NO3)2