题目内容
)已知甲、乙、丙、丁、戊、己为短周期元素形成的六种粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核单质分子,可与水发生置换反应,甲的电子式为 。
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,该反应的离子方程式为 。
(3)丙为含两种元素的分子,且原子个数比为1∶1,实验室中可以用丙制备氧气,反应的化学方程式为 。
(4)戊属于烃,已知1 g戊在氧气中完全燃烧放出52 kJ的热量, 戊燃烧的热化学方程式为 。
(5)己为两种元素组成的六原子分子,常用作火箭的燃料,则己的化学式为 ______________ ,分子中含有的化学键为 (填“离子键”或“共价键”)。己与丙反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为 。
(1)
(2)Cl2+HS-=S↓+2Cl-+H+
(3)2H2O2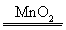 2H2O+O2↑
2H2O+O2↑
(4)C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH=-1 560 kJ/mol或2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 120 kJ·mol-1
O2(g)=2CO2(g)+3H2O(l) ΔH=-1 560 kJ/mol或2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 120 kJ·mol-1
(5)N2H4 共价键 N2H4+2H2O2=N2+4H2O
【解析】(1)含有18电子的双核单质分子只有F2,F2可与水发生反应生成HF和O2,F2的电子式为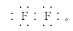
(2)18电子的双核离子只有HS-,HS-与Cl2反应为HS-+Cl2=H++2Cl-+S↓,有S沉淀生成,溶液变浑浊。
(3)含有两种元素的分子,原子个数比为1∶1的分子为H2O2,H2O2制取氧气的化学方程式为2H2O2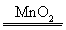 2H2O+O2↑。
2H2O+O2↑。
(4)含有18电子的烃为C2H6,1 g乙烷完全燃烧放出52 kJ热量,乙烷完全燃烧的化学方程式为2C2H6+7O2 4CO2+6H2O,乙烷完全燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 120 kJ·mol-1。
4CO2+6H2O,乙烷完全燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 120 kJ·mol-1。
(5)常用作火箭推进剂的六原子分子为N2H4,分子中含有的化学键为共价键。N2H4与H2O2反应生成N2与H2O,反应的化学方程式为N2H4+2H2O2=N2+4H2O

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案


