题目内容
【题目】水溶液中的离子平衡是中学学习的一个重要内容。请回答下列有关问题。
(1)常温下,用0.1000mol/L氨水滴定盐酸,当达到滴定终点时,溶液pH___7(填“>”、“<”或“=”),为了减小滴定误差,在滴定实验中使用的酸碱指示剂最好是___。(填字母)
A、甲基橙 B、酚酞 C、石蕊 D、以上均可
(2)常温下,将1 mL pH=12的NaOH溶液加水稀释到100mL,稀释后溶液中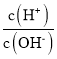 =___。
=___。
(3)某温度下,测得0.1 mol/LNaOH溶液pH为11,则该温度下水的离子积常数Kw=___。
(4)浓度相等的盐酸和醋酸各100mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2,则V1____V2(填“>”、“<”或“=”)
【答案】< A 10-6 10-12 =
【解析】
(1)常温下,用0.1000mol/L氨水滴定盐酸,当达到滴定终点时生成氯化铵,铵根离子水解溶液显酸性,当达到滴定终点时溶液的pH<7,溶液中各离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),指示剂变色范围为:酚酞8-10,甲基橙为3.1-4.4,石蕊为5-8,为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是甲基橙,故选A;
(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中c(OH-)=1×10-4mol/L,c(H+)=1×10-10mol/L,则: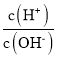 =1×10-6;
=1×10-6;
(3)某温度时,测得0.1molL-1的NaOH溶液的pH为11,该溶液中c(OH-)=0.1mol/L,c(H+)=![]() =10-11 mol/L,Kw=
=10-11 mol/L,Kw=![]() =0.1×10-11=10-12;
=0.1×10-11=10-12;
(4)浓度相等的盐酸和醋酸各100mL,HCl和醋酸的物质的量相等,分别与过量的Zn反应,生成氢气的体积相等,即V1=V2。

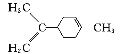
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。