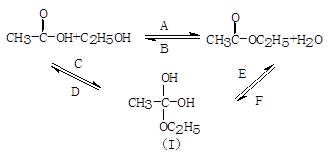题目内容
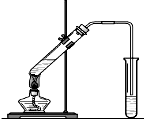
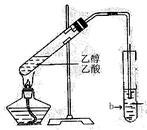
实验室用下图所示的装置制取乙酸乙酯。
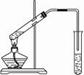
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,其操作步骤为 ___________ ____________________________________,然后轻轻振荡试管使之混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是____________________________________________。
(3)浓硫酸的作用是:①__________________;②____________________。
(4)图中右边试管中试剂是_______________。
(5)分离得到乙酸乙酯的方法是__________,分离需要的玻璃仪器是____________________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式____________________________________。
(7)写出乙酸与碳酸氢钠反应方程式_____________________________________。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,其操作步骤为 ___________ ____________________________________,然后轻轻振荡试管使之混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是____________________________________________。
(3)浓硫酸的作用是:①__________________;②____________________。
(4)图中右边试管中试剂是_______________。
(5)分离得到乙酸乙酯的方法是__________,分离需要的玻璃仪器是____________________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式____________________________________。
(7)写出乙酸与碳酸氢钠反应方程式_____________________________________。
(1)向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸
(2)挥发出的乙醇和乙酸易溶于水 ,溶于水后导管内压强减小引起倒吸(2分)
(3)催化剂,吸水剂 (各1分) (4)饱和碳酸钠溶液(1分)
(5) 分液(1分) ;分液漏斗、烧杯(各1分)
(6) CH3COOH + CH3CH218OH CH3CO18OCH2CH3 + H2O (2分)
CH3CO18OCH2CH3 + H2O (2分)
(7) CH3COOH + NaHCO3 ====CH3COONa + CO2 ↑ + H2O (2分)
(2)挥发出的乙醇和乙酸易溶于水 ,溶于水后导管内压强减小引起倒吸(2分)
(3)催化剂,吸水剂 (各1分) (4)饱和碳酸钠溶液(1分)
(5) 分液(1分) ;分液漏斗、烧杯(各1分)
(6) CH3COOH + CH3CH218OH
 CH3CO18OCH2CH3 + H2O (2分)
CH3CO18OCH2CH3 + H2O (2分)(7) CH3COOH + NaHCO3 ====CH3COONa + CO2 ↑ + H2O (2分)
试题分析:(1)由于浓硫酸溶于水放热,而乙醇和乙酸都是易挥发的,所以在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的操作步骤为向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸。
(2)由于挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小,从而引起倒吸。
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂。
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯.
(5)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,所以分离得到乙酸乙酯的方法是分液,分离需要的玻璃仪器是分液漏斗、烧杯。
(6)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,所以反应的化学方程式是CH3COOH + CH3CH218OH
 CH3CO18OCH2CH3 + H2O。
CH3CO18OCH2CH3 + H2O。(7)乙酸的酸性强于碳酸的,所以乙酸和碳酸氢钠反应的化学方程式是CH3COOH + NaHCO3 =CH3COONa + CO2 ↑ + H2O。
点评:该题是基础性试题的考查,试题紧扣教材基础知识,针对性强,旨在培养学生规范严谨的实验设计能力和动手操作能力,有利于激发学生的学习兴趣,增强学生的学习自信心。解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
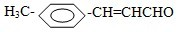 氧化为
氧化为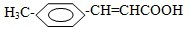 ,所用氧化剂最合理的是( )
,所用氧化剂最合理的是( )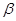 一紫罗兰酮的结构简式是
一紫罗兰酮的结构简式是 ,关于该有机物的说法正确的是
,关于该有机物的说法正确的是 ,R和R′为不同的烷基)类物质,关于邻苯二甲酸酯的下列叙述正确的是( )
,R和R′为不同的烷基)类物质,关于邻苯二甲酸酯的下列叙述正确的是( )