题目内容
1.20℃时,测得反应物A的反应速率为0.1mol/(L•s),已知温度每升高10℃,化学反应速率增大到原来的2倍,那么当现在改变温度后反应速率变成了1.6mol/(L•s)时,求改温度变成了多少℃( )| A. | 60℃ | B. | 50℃ | C. | 70℃ | D. | 40℃ |
分析 温度每升高10℃,反应速率增加到原来的2倍,该反应速率提高了$\frac{1.6}{0.1}$=16倍,以此来解答.
解答 解:温度每升高10℃,反应速率增加到原来的2倍,该反应速率提高了$\frac{1.6}{0.1}$=16倍,
由10℃增加n个10℃,速率为原来的16倍,
即2n=16,解得n=4,
所以反应所需温度为20℃+4×10℃=60℃,
故选A.
点评 本题考查影响化学反应速率的因素,把握温度对反应速率的影响及信息为解答的关键,注意速率变化倍数与温度关系,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列溶液中,溶液的物质的量浓度为1mol•L-1是( )
| A. | 将40gNaOH溶于1L水中所得的溶液 | |
| B. | 将58.5gNaCl溶于水配成1L溶液 | |
| C. | 将0.5mol•L-1氯化钠溶液100mL加热蒸发掉50g水的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
16.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2g 氢气所含原子数目为2NA | |
| B. | 36g H2O中含有的质子数为10NA | |
| C. | 标准状况下,11.2L水中含有的分子数是0.5NA | |
| D. | 1mol 氯气与足量水反应,转移的电子数是2NA |
6. 有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
 有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
13.已知:乙酸乙酯(C4H8O2)通常是无色液体,不溶于饱和碳酸钠溶液,密度小于1g•mL-1,要从饱和碳酸钠溶液与乙酸乙酯的混合物里将乙酸乙酯分离出来,试判断下列分离方法中最合理的是( )
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
10.己知一个反应只能在高温下进行,则它的逆反应( )
| A. | 只能在高温下进行 | |
| B. | 只能在低温下进行 | |
| C. | 可能在高温下进行,也可能能在高温下进行 | |
| D. | 在高温或低温下均不能进行 |
11.对于平衡体系mA(气)+nB(气)?PC(气)十qD(气)△H<0,有下列判断,其中正确的是( )
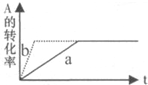

| A. | 若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1.8倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n | |
| C. | 若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q | |
| D. | 加催化剂或增大压强,可实现如图a→b的变化 |