题目内容
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
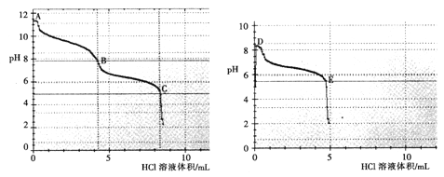
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
【答案】(1)碳酸钠与水反应生成Na2CO3·xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量。
(2)①BC;②NaCl和NaHCO3;③小于,B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点。
(3)2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑
【解析】
试题分析:(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是碳酸钠与水反应生成Na2CO3·xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;(2)① 碳酸钠与盐酸反应分2步,![]() 、
、![]() ,pH有两次突变,达到两次反应终点,分别是BC;②B点恰好完成
,pH有两次突变,达到两次反应终点,分别是BC;②B点恰好完成![]() 反应,所以B点的主要溶质是NaCl和NaHCO3;③ B点小于D点的pH,主要原因是B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3溶液加入镁粉,发现有气泡和沉淀生成,化学方程式:2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑。
反应,所以B点的主要溶质是NaCl和NaHCO3;③ B点小于D点的pH,主要原因是B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3溶液加入镁粉,发现有气泡和沉淀生成,化学方程式:2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案