题目内容
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A的最外层电子数是次外层电子数的两倍,C是该周期中原子半径最大的元素,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。试根据以上叙述回答:
(1)元素符号:B______;C______;E______ ;
(2)画出D的离子结构示意图_______________;AB2的结构式_______________;
(3)写出C2B2与AB2反应的化学方程式___________________________________________;在该反应中,1mol C2B2参与反应,则转移电子数目为______;
(4)D、E的气态氢化物的稳定性_________大于_________ (填化学式)。
【答案】 O Na Cl ![]() O=C=O 2Na2O2+2CO2=2Na2CO3+O2 NA或6.02×1023 HCl H2S
O=C=O 2Na2O2+2CO2=2Na2CO3+O2 NA或6.02×1023 HCl H2S
【解析】A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的最外层电子数是次外层电子数的两倍,最外层电子数不超过8个,K层不超过2个,则A原子次外层为K层,则A是C元素;A和B原子具有相同的电子层数,则B为第二周期元素;C是该周期中原子半径最大的元素,且C原子序数大于B,所以C为第三周期元素,为Na元素;C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B单质是氧气,B为O元素,D是S元素,E与D相邻,且原子序数大于D,所以E是Cl元素;
(1)通过以上分析知,B、C、E分别是氧、钠、氯元素,元素符号依次为O、Na、Cl;
(2)D是S元素,其原子核外有3个电子层、最外层有6个电子,其原子结构示意图为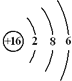 ;CO2是直线型结构,其结构式为O=C=O;
;CO2是直线型结构,其结构式为O=C=O;
(3)Na2O2与CO2发生反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2↑,此反应中Na2O2既是氧化剂,又是还原剂,氧元素的化合价从-1价升高为0价,当该反应中,1mol Na2O2参与反应,则转移电子数目为NA或6.02×1023;
(4)D是S元素、E是Cl元素,非金属性Cl>S,则氢化物的稳定性大小为:HCl>H2S。

