题目内容
 某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:
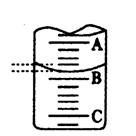
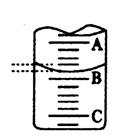
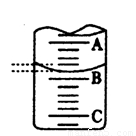
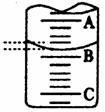
某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:①取25.00mL工厂废水放入锥形瓶中,加入2~3滴甲基橙指示剂,用 0.2020mol?L-1氢氧化钠溶液滴至终点,滴定前后滴定管中示数如右图.
②再取25.00mL工厂废水放入锥形瓶中,加入 0.2020mol?L-1NaOH溶液V1 mL(过量),振荡.然后加入2~3滴甲基橙试液,用0.1012mol?L-1的盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸V2mL.
③略.
(1)步骤①取25.00mL废水所用的仪器
酸式滴定管
酸式滴定管
,滴定时左手挤压玻璃球
挤压玻璃球
,眼睛注视锥形瓶溶液颜色变化
锥形瓶溶液颜色变化
.计算c(HCl)=0.1010
0.1010
mol?L-1.(2)步骤②滴定至终点观察到的实验现象
溶液的颜色由黄色橙色变成橙色,沉淀溶解
溶液的颜色由黄色橙色变成橙色,沉淀溶解
.步骤②测出氯化镁的浓度明显不合理,实验设计存在问题,请提出一种改进的方法过滤并洗涤沉淀,然后对滤液进行滴定
过滤并洗涤沉淀,然后对滤液进行滴定
.若改进后步骤②消耗盐酸的体积为V3mL.请列出计算c(MgCl2)的表达式| 0.2020mol/L×V1×10-3L-0.2020mol/L×0.0125L-0.1012mol/LV×3×10-3L |
| 0.025L×2 |
| 0.2020mol/L×V1×10-3L-0.2020mol/L×0.0125L-0.1012mol/LV×3×10-3L |
| 0.025L×2 |
(3)请设计另外一种测定该工业废水各组分浓度的实验方案并简述实验步骤.
分析:(1)根据酸式滴定管盛放酸性溶液;根据滴定操作的方法;根据读数求出氢氧化钠的体积,然后根据氢氧化钠与盐酸反应的关系式NaOH~HCl求出盐酸的物质的量浓度;
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH,根据用甲基橙试液作指示剂,碱滴定酸时到终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;根据废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀;根据步骤①用氢氧化钠溶液滴至终点,滴定前后滴定管中示数如右图求出与氯化镁反应的氢氧化钠的物质的量;根据步骤②用盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸的体积求出过量的氢氧化钠的物质的量,最后用总的氢氧化钠的物质的量-与氯化镁反应的氢氧化钠的物质的量-过量的氢氧化钠的物质的量=与盐酸反应的氢氧化钠的物质的量,最后求出盐酸的物质的量浓度;
(3)根据在一定量的废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度.在一定量废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度.
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH,根据用甲基橙试液作指示剂,碱滴定酸时到终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;根据废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀;根据步骤①用氢氧化钠溶液滴至终点,滴定前后滴定管中示数如右图求出与氯化镁反应的氢氧化钠的物质的量;根据步骤②用盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸的体积求出过量的氢氧化钠的物质的量,最后用总的氢氧化钠的物质的量-与氯化镁反应的氢氧化钠的物质的量-过量的氢氧化钠的物质的量=与盐酸反应的氢氧化钠的物质的量,最后求出盐酸的物质的量浓度;
(3)根据在一定量的废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度.在一定量废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度.
解答:解:(1)根据废水呈酸性,所以取25.00mL废水所用的仪器为25.00mL酸式滴定管;
滴定时左手挤压玻璃球,眼睛注视锥形瓶溶液颜色变化;
消耗氢氧化钠的体积为13.90mL-1.40 mL=12.50mL
氢氧化钠与盐酸反应的关系式 NaOH~HCl
1 1
0.2020mol?L-1×12.50mL C(HCl)×25.00mL
C(HCl)=0.1010mol/L
故答案为:酸式滴定管;挤压玻璃球,锥形瓶溶液颜色变化;0.1010;
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH溶液,所以终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀,所以过滤并洗涤沉淀,然后对滤液进行滴定,与氯化镁反应的氢氧化钠的物质的量为:0.2020mol?L-1×0.0125L,总的氢氧化钠的物质的量为:0.2020mol?L-1×V1×10-3L,过量的氢氧化钠的物质的量为:0.1012mol?L-1×V3×10-3L,
则氯化镁的物质的量浓度为
,
故答案为:溶液的颜色由黄色橙色变成橙色,沉淀溶解;过滤并洗涤沉淀,然后对滤液进行滴定;
;
(3)取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度,
答:取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重.计算出盐酸的浓度.
滴定时左手挤压玻璃球,眼睛注视锥形瓶溶液颜色变化;
消耗氢氧化钠的体积为13.90mL-1.40 mL=12.50mL
氢氧化钠与盐酸反应的关系式 NaOH~HCl
1 1
0.2020mol?L-1×12.50mL C(HCl)×25.00mL
C(HCl)=0.1010mol/L
故答案为:酸式滴定管;挤压玻璃球,锥形瓶溶液颜色变化;0.1010;
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH溶液,所以终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀,所以过滤并洗涤沉淀,然后对滤液进行滴定,与氯化镁反应的氢氧化钠的物质的量为:0.2020mol?L-1×0.0125L,总的氢氧化钠的物质的量为:0.2020mol?L-1×V1×10-3L,过量的氢氧化钠的物质的量为:0.1012mol?L-1×V3×10-3L,
则氯化镁的物质的量浓度为
| 0.2020mol/L×V1×10-3L-0.2020mol/L×0.0125L-0.1012mol/LV×3×10-3L |
| 0.025L×2 |
故答案为:溶液的颜色由黄色橙色变成橙色,沉淀溶解;过滤并洗涤沉淀,然后对滤液进行滴定;
| 0.2020mol/L×V1×10-3L-0.2020mol/L×0.0125L-0.1012mol/LV×3×10-3L |
| 0.025L×2 |
(3)取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度,
答:取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重.计算出盐酸的浓度.
点评:本题主要考查了物质成分的测定,难度不大,注意氢氧化钠与各物质之间的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (3)Cl2的实际浓度比所测浓度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是 。(若认为没有误差,此问不答)
(3)Cl2的实际浓度比所测浓度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是 。(若认为没有误差,此问不答)