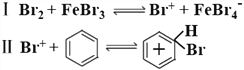
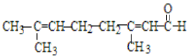题目内容
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意图如下,下列说法中正确的是

A.b极为电池的负极
B.电池工作时电子在内电路中由a极经溶液到b极
C.电池负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+
D.电池工作时,1mol乙醇被氧化时有6mol电子转移
【答案】C
【解析】
试题分析:A.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故A错误;B.电池工作时,电子在外电路中由a极经溶液到b极,内电路中是电解质溶液中的阴阳离子定向移动,故B错误;C.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,燃料乙醇在负极发生失电子的氧化反应,负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+,故C正确;D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,则1mol乙醇被氧化失去12mol电子,所以1mol乙醇被氧化电路中转移12NA的电子,故D错误;答案为C。

【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸 > 硝酸 |
B、 | 向1mL 某溶液中,滴入2 mL 0.1 mol·L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
C、 | 取5 mL 0.1 mol·L-1FeCl3溶液,滴加5滴0.1 mol·L-1KI溶液,振荡,再加入5 mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色。 | KI和FeCl3反应有一定的限度 |
D、 | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
A. A B. B C. C D. D
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9 :5,此时溶液pH=5
C. 碳酸钠溶液中滴加少量氯水的离子方程式是2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀