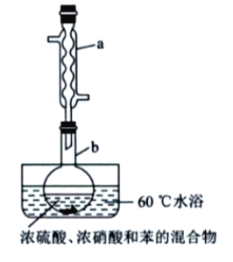
题目内容
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
【答案】>1.5a 0 0.5 am或者![]()
【解析】
恒温恒压下,对于N2+3H22NH3反应来说,欲保持平衡时各组分的体积分数不变,则应采用一边倒的方法,将产物全部转化为反应物,然后利用各反应物的物质的量之比等于化学计量数之比的原则,求各反应物的物质的量。
温度、压强一定时,当各生成物的物质的量为0,反应物的物质的量之比等于化学计量数之比时,达等效平衡状态。
①把物质的量改写为n(N2)=1.5mol,n(H2)=6mol,达平衡后,再加入3molH2。n(N2)=1.5mol,n(H2)=6mol时,与已知平衡体系等效,此时生成NH3的物质的量为1.5amol,再加入3molH2,平衡正向移动,NH3的物质的量增大,所以平衡时,n(NH3)>1.5amol。
②设起始时,n(N2)=x,n(H2)=y,将NH3全部转化为反应物,此时N2的物质的量为x+0.5mol,H2的物质的量为y+1.5mol,由于平衡时n(NH3)=0.5amol,为原平衡体系的0.5倍,所以采用一边倒后,各反应物的物质的量也为已知平衡体系中起始量的0.5倍,所以x+0.5=0.5,x=0;y+1.5=2,y=0.5;
③起始时,n(N2)=m,n(H2)= g(g=4m), n(NH3)=0,与题干中的平衡体系等效,所以达平衡时,n(NH3)为原平衡时的m倍或![]() 倍,所以n(NH3)= am或者
倍,所以n(NH3)= am或者![]() 。
。
答案为:>1.5a;0;0.5;am或者![]() 。
。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
【题目】下表是3种物质的溶解度![]() ,下列说法中正确的是
,下列说法中正确的是![]()
物质 |
|
|
|
溶解度 | 74 |
|
|
A.已知![]() 的
的![]()
![]() ,则所有含有固体
,则所有含有固体![]() 的溶液中,都有
的溶液中,都有![]() ,且
,且![]()
![]()
B.除去粗盐中含有的![]() 杂质,最佳除杂试剂为
杂质,最佳除杂试剂为![]() 溶液
溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有![]() 和
和![]() 的硬水,发生的离子反应方程式为
的硬水,发生的离子反应方程式为![]()