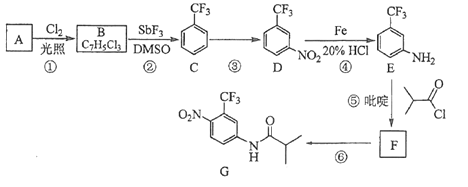
题目内容
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
【答案】CaC2+2H2O→Ca(OH)2+HC≡CH↑ 减慢反应速率 除H2S等气体 紫色溶液褪色 检验纯度或验纯 1种 ![]() ×100%或 64b/26a×100%
×100%或 64b/26a×100%
【解析】
电石和水制取乙炔,由于电石中会混有硫、磷等杂质,所以生成的乙炔中会混有硫化氢、磷化氢等化合物,导致生成的乙炔有特殊难闻的臭味,硫酸铜溶液可以除去硫化氢和磷化氢。乙炔可以使酸性高锰酸钾溶液褪色,也可以和溴发生加成反应。
(1)电石(碳化钙CaC2)与水制取乙炔的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑。
(2)电石和水反应非常剧烈,可以用饱和食盐水代替蒸馏水减慢反应速率。
(3)硫酸铜和H2S可以发生复分解反应从而除去H2S:H2S+CuSO4=CuS↓+H2SO4。乙炔能把酸性高锰酸钾溶液还原成Mn2+,所以高锰酸钾溶液的紫色会褪去。
(4)乙炔是可燃性气体,如果点燃不纯的乙炔,会发生爆炸,所以在点燃乙炔前,首先应该检验乙炔的纯度。
(5)乙烷中的6个氢原子是等效氢原子,乙烷在光照条件下与氯气反应,生成的一氯代烷只有1种。
(6)乙炔全部通入足量溴的CCl4溶液中,乙炔和溴发生加成反应,溶液增重的b g即为生成的乙炔的质量,所以乙炔的物质的量为![]() mol,根据反应方程式CaC2+2H2O→Ca(OH)2+HC≡CH↑,乙炔和碳化钙的物质的量相等,所以碳化钙的质量为
mol,根据反应方程式CaC2+2H2O→Ca(OH)2+HC≡CH↑,乙炔和碳化钙的物质的量相等,所以碳化钙的质量为![]() ×64g,则CaC2的纯度为
×64g,则CaC2的纯度为![]() ×100%或 64b/26a×100%。
×100%或 64b/26a×100%。

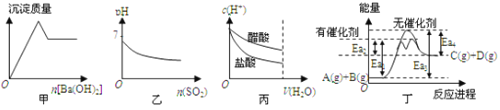
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
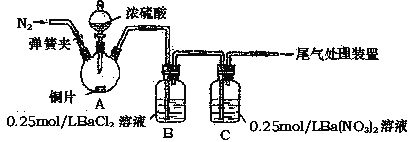
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |