题目内容
【题目】亚硝酸钠广泛用于印染漂白、食品等行业,常作媒染剂、漂白剂、食品添加剂等。某兴趣小组用下列装證制备NaNO2。
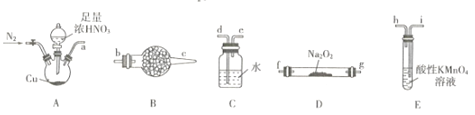
已知:①2NO+Na2O2=2NaNO2; ②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为____,装置C的作用是_______。
(4)装置E中发生反应的离子方程式为_____________。
(5)为测定亚硝酸钠的含量,称取3.000g样品溶于水配成500mL.溶液,量取25.00mL溶液于锥形瓶中,硫酸酸化后加入过量KI,发生反应:2NO2-+2I-+4H+=2NO↑+I2+2H2O(杂质不参与反应)。然后用0.1000mol/LNa2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=S4O62-+2I-),消耗20.00mL。
①该实验可选用的指示剂为_____,达到滴定终点时的现象是__________。
②所得样品中亚硝酸钠的质量分数为____________。
③下列操作会导致测定结果偏高的是_______(填代号)。
a.滴定过程中向锥形瓶中加少量水
b.消定前滴定管尖嘴部分有气泡,滴定后气泡消失
c.读数时,滴定前仰视,滴定后府视
d.滴定时,标准被滴到锥形瓶外
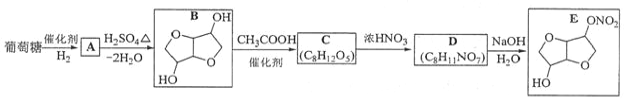
【答案】d→e→b→c→f(或g)→g(或f)→i排除装置中的空气,防止一氧化氮被氧化为二氧化氮碱石灰或无水氯化钙将NO2转化为NO5NO+3MnO2+4H+=5NO3-+3Mn2++2H2O淀粉溶液滴入最后一滴标准溶液,溶液由蓝色变为无色,且半分钟内不恢复蓝色92%bd
【解析】
(1)制备NaNO2,A装置制备NO2,由NO2与水反应制备NO,则a连接d,过氧化钠与水反应,故NO先干燥再与过氧化钠反应,e连接U形干燥管b,与过氧化钠在D中反应生成亚硝酸钠,c连接f,NO不能直接排放到空气中,用酸性高锰酸钾吸收,g连接i,d→e→b→c→f(或g)→g(或f)→I;
(2)一氧化氮易被空气中的氧气氧化为二氧化氮,空气中的二氧化碳和水均可以和过氧化钠反应,实验前应先排进尽装置内的空气,实验开始时,先通一段时间N2,排除装置中的空气;
(3)装置B目的为干燥NO,干燥的NO再与过氧化钠反应,因此B中盛放试剂是碱石灰或无水氯化钙;A装置制备NO2, 装置C的作用将NO2与水反应制备NO;
(4)装置E为为尾气吸收装置,离子方程式为:5NO+3MnO2+4H+=5NO3-+3Mn2++2H2O;
(5)①亚硝酸钠中加入硫酸酸化后的过量KI,发生反应:2NO2-+2I-+4H+=2NO↑+I2+2H2O,产物中有碘单质,再用硫代硫酸钠来还原碘单质,碘单质可以使淀粉溶液变蓝,因此可用淀粉溶液作指示剂,滴定终点为滴入最后一滴标准溶液,溶液由蓝色变为无色,且半分钟内不恢复蓝色;
②根据反应2NO2-+2I-+4H+=2NO↑+I2+2H2O和I2+2S2O32-=S4O62-+2I-可得对应关系2NO2-~ I2~2S2O32-,因此c(NaNO2)×V(NaNO2)= c(NaS2O3)×V(NaS2O3),c(NaNO2)=0.1000mol/L ×0.02L÷0.025L=0.08mol/L,m(NaNO2)= c(NaNO2)×V(NaNO2) ×M(NaNO2)= 0.08mol/L×0.5L×69g/mol=2.76g,所以亚硝酸钠的质量分数为2.76g÷3gc×100%=92%;
③a.滴定过程中向锥形瓶中加少量水,不影响滴定结果;
b.消定前滴定管尖嘴部分有气泡,滴定后气泡消失,造成硫代硫酸钠体积增大,结果偏高;
c.读数时,滴定前仰视,滴定后府视,造成硫代硫酸钠体积减小,结果偏低;
d.滴定时,标准被滴到锥形瓶外,造成硫代硫酸钠体积增大,结果偏高;
综上所述,本题应选bd。