��Ŀ����
��2013?��������ģ��ij�л���Aֻ��̼���⡢������Ԫ�أ�������̼���⡢��ԭ�Ӹ�����Ϊ4��5��1 0.1mol A������̼��������Һ��Ӧ���ɶ�����̼����2.24L����״������DҲ����̼��������Һ��Ӧ���ɶ�����̼�����ⶨA����Է�������������200�����л����ת����ϵ��ͼ��ʾ����֪��

��1��A�ķ���ʽ��
��2��д����Ӧ���͢ڣ�
��3��H��A��Ϊͬ���칹�壬д��������������H�Ľṹ��ʽΪ
 ��
��
�����ڷ����廯�����ұ�����������ȡ������
�ڱ����ϵ�һ�ȴ���ֻ��2�֣�
��1mol H������NaOH��Һ��Ӧ��������2mol NaOH��
��4��д��������G�Ľṹ��ʽ��
 ��
��
��5��д����C����D�Ļ�ѧ����ʽ
 ��
��
��6����ƴ�CH3CHClCH2COOH��B�ĺϳ�·�ߣ����Լ���ѡ���úϳ�·������ͼ��ʾ����
ʾ����CH2=CH2
CH3CH2Br
CH3CH2OH


��1��A�ķ���ʽ��
C8H10O2
C8H10O2
��A���������ŵ�����̼̼˫�����Ȼ�
̼̼˫�����Ȼ�
����2��д����Ӧ���͢ڣ�
�ӳɷ�Ӧ
�ӳɷ�Ӧ
���ݣ�������Ӧ��ȡ����Ӧ
������Ӧ��ȡ����Ӧ
����3��H��A��Ϊͬ���칹�壬д��������������H�Ľṹ��ʽΪ


�����ڷ����廯�����ұ�����������ȡ������
�ڱ����ϵ�һ�ȴ���ֻ��2�֣�
��1mol H������NaOH��Һ��Ӧ��������2mol NaOH��
��4��д��������G�Ľṹ��ʽ��


��5��д����C����D�Ļ�ѧ����ʽ


��6����ƴ�CH3CHClCH2COOH��B�ĺϳ�·�ߣ����Լ���ѡ���úϳ�·������ͼ��ʾ����
ʾ����CH2=CH2
| HBr |
| NaOH |
| ˮ/�� |

������n��CO2��=
=0.1mol��0.1mol A������̼��������Һ��Ӧ���ɶ�����̼����2.24L����״��������˵��һ��A�����к���1���Ȼ���A�ܱ����Ը��������Һ��������A�к���̼̼˫�����л���Aֻ��̼���⡢������Ԫ�أ�A����Է�������������200��A������̼���⡢��ԭ�Ӹ�����Ϊ4��5��1�����D��G�Ļ�ѧʽ֪��A�к���8��̼ԭ�ӡ�10����ԭ�Ӻ�2����ԭ�ӣ��仯ѧʽΪ��C8H10O2��D�����к���2�ֻ�������ԭ�ӣ����ܺ�̼�����Ʒ�Ӧ��˵��D�к����Ȼ�����D�Ľṹ��ʽΪ��HOOCCH=CHCOOH��A�����Ը��������Һ��������B��B�ܺ����������ӳɷ�Ӧ����B�к����ʻ���B�������ӳ����ɵ�C�к��д��ǻ���
������Ũ����������������������C������ȥ��Ӧ����D������C�Ľṹ��ʽΪ��HOOCCH��OH��CH2COOH��B�Ľṹ��ʽΪ��HOOCCOCH2COOH��
E�ܷ����ӳɷ�Ӧ����E�к����ʻ���E�������ӳ����ɵ�F�к��д��ǻ���F��Ũ���������������������·�����Ӧ����G��G�ǰ�Ԫ��״���������F�к����Ȼ��ʹ��ǻ�������A�ķ���ʽ��B��̼ԭ����֪��E��F�ж�����4��̼ԭ�ӣ�����G�Ľṹ��ʽΪ�� ��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��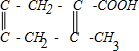 ��������ʵĽṹ�����ʽ��
��������ʵĽṹ�����ʽ��
| 2.24L |
| 22.4L/mol |
������Ũ����������������������C������ȥ��Ӧ����D������C�Ľṹ��ʽΪ��HOOCCH��OH��CH2COOH��B�Ľṹ��ʽΪ��HOOCCOCH2COOH��
E�ܷ����ӳɷ�Ӧ����E�к����ʻ���E�������ӳ����ɵ�F�к��д��ǻ���F��Ũ���������������������·�����Ӧ����G��G�ǰ�Ԫ��״���������F�к����Ȼ��ʹ��ǻ�������A�ķ���ʽ��B��̼ԭ����֪��E��F�ж�����4��̼ԭ�ӣ�����G�Ľṹ��ʽΪ��
 ��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��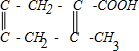 ��������ʵĽṹ�����ʽ��
��������ʵĽṹ�����ʽ������⣺n��CO2��=
=0.1mol��0.1mol A������̼��������Һ��Ӧ���ɶ�����̼����2.24L����״��������˵��һ��A�����к���1���Ȼ���A�ܱ����Ը��������Һ��������A�к���̼̼˫�����л���Aֻ��̼���⡢������Ԫ�أ�A����Է�������������200��A������̼���⡢��ԭ�Ӹ�����Ϊ4��5��1�����D��G�Ļ�ѧʽ֪��A�к���8��̼ԭ�ӡ�10����ԭ�Ӻ�2����ԭ�ӣ��仯ѧʽΪ��C8H10O2��D�����к���2�ֻ�������ԭ�ӣ����ܺ�̼�����Ʒ�Ӧ��˵��D�к����Ȼ�����D�Ľṹ��ʽΪ��HOOCCH=CHCOOH��A�����Ը��������Һ��������B��B�ܺ����������ӳɷ�Ӧ����B�к����ʻ���B�������ӳ����ɵ�C�к��д��ǻ���
������Ũ����������������������C������ȥ��Ӧ����D������C�Ľṹ��ʽΪ��HOOCCH��OH��CH2COOH��B�Ľṹ��ʽΪ��HOOCCOCH2COOH��
E�ܷ����ӳɷ�Ӧ����E�к����ʻ���E�������ӳ����ɵ�F�к��д��ǻ���F��Ũ���������������������·�����Ӧ����G��G�ǰ�Ԫ��״���������F�к����Ȼ��ʹ��ǻ�������A�ķ���ʽ��B��̼ԭ����֪��E��F�ж�����4��̼ԭ�ӣ�����G�Ľṹ��ʽΪ�� ��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��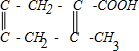 ��
��
��1��ͨ�����Ϸ���֪��A�ķ���ʽΪ��C8H10O2��A�Ľṹ��ʽΪ��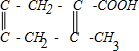 ������A�к���̼̼˫�����Ȼ���
������A�к���̼̼˫�����Ȼ���
�ʴ�Ϊ��C8H10O2��̼̼˫�����Ȼ���
��2���ڷ����ӳɷ�Ӧ���ݷ���������Ӧ��ȡ����Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��������Ӧ��ȡ����Ӧ��
��3�������ڷ����廯�����ұ�����������ȡ�������ڱ����ϵ�һ�ȴ���ֻ��2�֣�˵��������ֻ��������ԭ�ӣ���1molH������NaOH��Һ��Ӧ��������2molNaOH����˵��A�к����������ǻ������Է���������H�Ľṹ��ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��4��ͨ�����Ϸ���֪��G�Ľṹ��ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5����C����D�Ļ�ѧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��6��B�Ľṹ��ʽΪ��HOOCCOCH2COOH����4-�ȶ���ϳ�HOOCCOCH2COOH��4-�ȶ�����������ƵĴ���Һ������ȥ��Ӧ����CH2=CHCH2COONa��CH2=CHCH2COONa�ٺ��巢���ӳɷ�Ӧ����CH2BrCHBrCH2COOH��CH2BrCHBrCH2COOH�ٺ��������Ƶ�ˮ��Һ����ȡ����Ӧ����CH2OHCHOHCH2COOH����ͭ�����������������£�CH2OHCHOHCH2COOH����������HOOCCOCH2COOH���ʴ�Ϊ��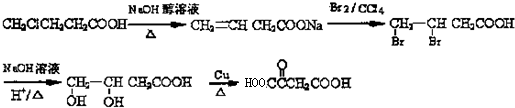 ��
��
| 2.24L |
| 22.4L/mol |
������Ũ����������������������C������ȥ��Ӧ����D������C�Ľṹ��ʽΪ��HOOCCH��OH��CH2COOH��B�Ľṹ��ʽΪ��HOOCCOCH2COOH��
E�ܷ����ӳɷ�Ӧ����E�к����ʻ���E�������ӳ����ɵ�F�к��д��ǻ���F��Ũ���������������������·�����Ӧ����G��G�ǰ�Ԫ��״���������F�к����Ȼ��ʹ��ǻ�������A�ķ���ʽ��B��̼ԭ����֪��E��F�ж�����4��̼ԭ�ӣ�����G�Ľṹ��ʽΪ��
 ��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��CH3CH��OH��CH2COOH��E�Ľṹ��ʽΪ��CH3COCH2COOH������B��E�Ľṹ��ʽ֪��A�Ľṹ��ʽΪ��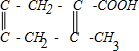 ��
����1��ͨ�����Ϸ���֪��A�ķ���ʽΪ��C8H10O2��A�Ľṹ��ʽΪ��
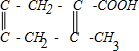 ������A�к���̼̼˫�����Ȼ���
������A�к���̼̼˫�����Ȼ����ʴ�Ϊ��C8H10O2��̼̼˫�����Ȼ���
��2���ڷ����ӳɷ�Ӧ���ݷ���������Ӧ��ȡ����Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��������Ӧ��ȡ����Ӧ��
��3�������ڷ����廯�����ұ�����������ȡ�������ڱ����ϵ�һ�ȴ���ֻ��2�֣�˵��������ֻ��������ԭ�ӣ���1molH������NaOH��Һ��Ӧ��������2molNaOH����˵��A�к����������ǻ������Է���������H�Ľṹ��ʽΪ��
 ��
���ʴ�Ϊ��
 ��
����4��ͨ�����Ϸ���֪��G�Ľṹ��ʽΪ��
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����5����C����D�Ļ�ѧ����ʽΪ��
 ��
���ʴ�Ϊ��
 ��
����6��B�Ľṹ��ʽΪ��HOOCCOCH2COOH����4-�ȶ���ϳ�HOOCCOCH2COOH��4-�ȶ�����������ƵĴ���Һ������ȥ��Ӧ����CH2=CHCH2COONa��CH2=CHCH2COONa�ٺ��巢���ӳɷ�Ӧ����CH2BrCHBrCH2COOH��CH2BrCHBrCH2COOH�ٺ��������Ƶ�ˮ��Һ����ȡ����Ӧ����CH2OHCHOHCH2COOH����ͭ�����������������£�CH2OHCHOHCH2COOH����������HOOCCOCH2COOH���ʴ�Ϊ��
 ��
�����������⿼���л�����ƶϼ��ϳɣ���ȷ�л���Ĺ����ż��������ǽⱾ��ؼ�������������Ϣ��ȡ���������ϵķ��������Ƶ���ͬʱ����ѧ���Ķ�������֪ʶ�������ѵ����л��ϳ�·�ߵ���ƣ��Ѷ��еȣ�

��ϰ��ϵ�д�
 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
�����Ŀ
 ��2013?��������ģ����ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ���ڢ��зֱ����2mol X��2mol Y����ʼʱ�����������ΪVL��������Ӧ2X������+Y������?aZ��g�����ﵽƽ��״̬��ʱ����X��Y��Z�����ʵ���֮��Ϊ1��3��2�������ж���ȷ���ǣ�������
��2013?��������ģ����ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ���ڢ��зֱ����2mol X��2mol Y����ʼʱ�����������ΪVL��������Ӧ2X������+Y������?aZ��g�����ﵽƽ��״̬��ʱ����X��Y��Z�����ʵ���֮��Ϊ1��3��2�������ж���ȷ���ǣ������� ��2013?��������ģ��Ϊ��СCO2�Ի�����Ӱ�죬���������ŷ�����ͬʱ��Ӧ��ǿ��CO2�������õ��о���
��2013?��������ģ��Ϊ��СCO2�Ի�����Ӱ�죬���������ŷ�����ͬʱ��Ӧ��ǿ��CO2�������õ��о���