题目内容
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

【答案】![]() sp3 正四面体形 109°28′ 5:1 > Ca的原子半径较大,且价电子较少,金属键较弱 12
sp3 正四面体形 109°28′ 5:1 > Ca的原子半径较大,且价电子较少,金属键较弱 12 ![]()
【解析】
(1)Fe为26号元素,失去最外层3个电子形成Fe3+,所以Fe3+价层电子的轨道表达式(电子排布图)为![]() ;
;
(2)SiH4分子中心Si原子的价层电子对数为![]() ,孤电子对数为0,为sp3杂化,空间构型为正四面体,键角为109°28′;Si2H4分子结构与C2H4,有一个Si=Si双键,四个Si-H单键,所以σ键和π键的数目之比5:1;
,孤电子对数为0,为sp3杂化,空间构型为正四面体,键角为109°28′;Si2H4分子结构与C2H4,有一个Si=Si双键,四个Si-H单键,所以σ键和π键的数目之比5:1;
(3)Mg的最外层为半满状态,其第一电离大于同周期相邻元素,所以第一电离能Mg>Al;
(4)金属的熔沸点与金属键强弱有关,与Fe相比Ca的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低;
(5)以顶点的原子分析,位于面心的原子与之相邻最近,1个顶点原子为12个面共用,故配位数为12;根据其晶胞模型可知,面对角线上三个原子相切,设晶胞边长为acm,则有2a2=(4r)2,解得a=![]() cm,则晶胞体积V=a3=
cm,则晶胞体积V=a3=![]() cm3;根据均摊法可知该晶胞含有Ag原子个数为
cm3;根据均摊法可知该晶胞含有Ag原子个数为![]() ,所以晶胞的质量m=
,所以晶胞的质量m=![]() ,则晶胞的密度
,则晶胞的密度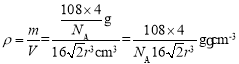 。
。

 阅读快车系列答案
阅读快车系列答案