题目内容
有两种金属的合金12g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是
| A.Mg和Al | B.Cu和Zn | C.Fe和Zn | D.Al和Fe |
D
试题分析:标准状况下11.2L氢气的物质的量为11.2L/22.4(L/mol) =0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为24,
A、Al的化合价为+2价时,可看成其相对原子质量为(2/3)×27=18,Mg的相对原子质量为24,二者平均相对原子质量介于18~24之间,小于金属混合物的平均相对原子质量为24,故A错误;
B、Cu不反应,其的相对原子质量看做无穷大, Zn的相对原子质量为65,二者平均相对原子质量介于65~无穷大之间,大于金属混合物的平均相对原子质量为24,故B错误;
C、Fe的相对原子质量为56,Zn的相对原子质量为65,二者平均相对原子质量介于56~65之间,大于金属混合物的平均相对原子质量为24,故C错误;
D、当Al的化合价为+2价时,可看成其相对原子质量为(2/3)×27=18,Fe的相对原子质量为56,二者平均相对原子质量介于18~56之间,平均值可能为24,故D正确。
故选:D。
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法即可快速解答,注意化合价与相对原子质量的转化。

练习册系列答案
相关题目
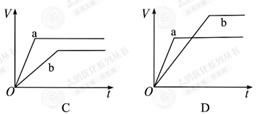
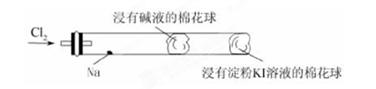
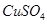 溶液,下列图示表示产生
溶液,下列图示表示产生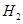 的体积(V)与时间(t)的关系,其中正确的是
的体积(V)与时间(t)的关系,其中正确的是