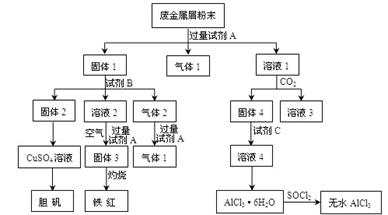
题目内容
14g铜银合金跟足量的某浓度HNO3反应,将放出的气体与1.12LO2(标况)混合,通入水中,恰好全部吸收,则合金中铜的质量是
| A.1.6g | B.3.2g | C.6.4g | D.9.6g |
B
试题分析:金属和硝酸反应,金属失去电子,硝酸被还原。由于硝酸的还原产物和氧气反应又生成硝酸,这说明金属失去的电子相当于被氧气获得,氧气的物质的量是1.12L÷22.4L/mol=0.05mol,得到0.05mol×4=0.2mol电子。设铜的物质的量是x、银是y,则64x+108y=14g、2x+y=0.2mol,解得x=0.05mol,y=0.1mol。所以铜的质量是3.2g,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重对硝酸能力的考查。该题的关键是明确金属失去的电子转移到氧气中,然后依据电子的得失守恒列式计算即可。

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案
相关题目