题目内容
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
压强比值P后/P前 | 0.98 | 0.88 | 0.80 | 0.75 | 0.75 | 0.75 |
(1)0~15min内,用H2表示的平均反应速率为v(H2) =___________________mol·L-1·min-1。
(2)达到平衡时N2的转化率为________,该温度下的平衡常数为___________(保留两位小数)。
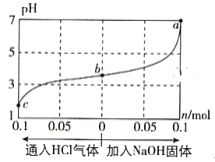
(3)已知该反应为放热反应,下图为不同条件下反应速率随时间的变化情况(每次仅改变一个条件):a时改变的条件可能是____________;b时改变的条件可能是_______________。

(4)一定条件下的密闭容器中,该反应达到平衡后要提高H2的转化率,可以采取的措施有(_________)
A.低温低压 B.加入催化剂 C.增加N2的浓度 D.增加H2的浓度 E.分离出NH3
【答案】0.08 50% 0.59 加入催化剂 加入N2或H2 CE
【解析】
在计算反应速率时,要注意题干中提供的是物质的物质的量还是物质的量浓度,以选择合适的公式正确计算;由题中提供的表格可知,大约20min时,该反应达到平衡状态,平衡状态时,压强变为初始的0.75倍,借助公式![]() 可知此时容器内气体的总物质的量,再经过三段式计算即可得到此条件下的K;一般,升高温度或增大压强会使反应速率都增大,温度变化导致速率改变的同时,平衡状态也必然发生移动,但压强就不一定;对于催化剂,其加入会使反应速率都增加,同时也不会影响平衡状态;转化率与多种因素有关,如温度,压强,浓度以及投料比等。
可知此时容器内气体的总物质的量,再经过三段式计算即可得到此条件下的K;一般,升高温度或增大压强会使反应速率都增大,温度变化导致速率改变的同时,平衡状态也必然发生移动,但压强就不一定;对于催化剂,其加入会使反应速率都增加,同时也不会影响平衡状态;转化率与多种因素有关,如温度,压强,浓度以及投料比等。
(1)0~15min,压强变为最初的0.80倍,由公式![]() 可知,气体总物质的量变化为初始的0.80倍,列三段式:
可知,气体总物质的量变化为初始的0.80倍,列三段式: ,则有
,则有![]() ,解得x=0.4,所以15min内氢气的量减少了1.2mol,那么
,解得x=0.4,所以15min内氢气的量减少了1.2mol,那么![]() ;
;
(2)由题可知,达到平衡时,气体的压强变为初始的0.75倍,由公式![]() 可知,气体总物质的量变为初始的0.75倍,列三段式:
可知,气体总物质的量变为初始的0.75倍,列三段式: ,则有
,则有![]() ,解得x=0.5,所以平衡时,N2,H2,NH3的物质的量分别为0.5mol,1.5mol,1mol,浓度即分别0.5mol/L,1.5mol/L,1mol/L,所以平衡状态时N2转化率为:
,解得x=0.5,所以平衡时,N2,H2,NH3的物质的量分别为0.5mol,1.5mol,1mol,浓度即分别0.5mol/L,1.5mol/L,1mol/L,所以平衡状态时N2转化率为:![]() ,平衡常数为:
,平衡常数为: ;
;
(3)由图可知,a时改变条件后,正逆反应速率都增大,但是平衡状态未发生变化,考虑到该反应若只改变压强平衡一定会发生移动,所以改变的条件只能是催化剂的加入;b时,条件改变后逆反应速率未变化,而正反应速率瞬间增大,所以条件可能是增大反应物N2或H2的浓度;
(4)A.该反应是放热反应,因此低温条件下有利于反应正向进行,对提高氢气转化率有帮助;由于该反应气体总量减小,所以减压会使反应逆向进行,对提高氢气转化率不利,A项错误;
B.催化剂对于平衡无影响,无法改变氢气的转化率,B项错误;
C.仅增大氮气的浓度,会使平衡正向移动,氢气转化率提高,C项正确;
D.增加氢气的浓度,虽然会使平衡正向移动,但是相反的,氢气的转化率会下降,D项错误;
E.将产物氨气从体系内分离出去,可以使平衡正向移动,进而提高氢气的转化率,E项正确;
答案选CE。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D