题目内容
如图2所示,反应3A(g)+B(g)  2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )
2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )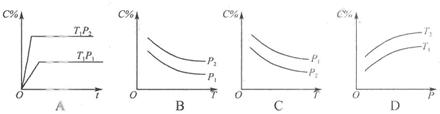
 2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )
2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )
C
略

练习册系列答案
相关题目
题目内容
 2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )
2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是( )
