题目内容
(9分)2.4克镁与稀盐酸恰好完全反应,计算:
(1)在标准状态下生成H2多少升?
(2)若完全反应后所得溶液的体积为125毫升,则所得溶液的物质的量浓度为多少?
(3)若把镁离子全部转化为氢氧化镁则需要1mol / L的氢氧化钠多少毫升?
【答案】
(1)2.24L (2)0.8mol/L (3)200mL
【解析】
试题分析:(1)Mg + 2HCl = MgCl2 + H2↑
1 1 1
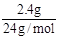 xmol
xmol
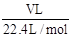
则x=0.1mol V=2.24L
(2)所得溶液的浓度为 。
。
(3)Mg2+ + 2OH- = Mg(OH)2,则0.1mol
Mg2+需要OH- 0.2mol,则NaOH的体积为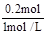 = 0.2L=200mL。
= 0.2L=200mL。
考点:物质的量浓度的计算
点评:本题非常基础简单。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目